题目内容
17.有一未完成的离子方程式:( )+RO32-+6H+=3R+3H2O,据此判断,R元素的最高价氧化物对应的水化物的化学式为( )| A. | H2RO3 | B. | H2RO4 | C. | HRO3 | D. | HRO4 |
分析 由离子方程式:( )+RO32-+6H+=3R+3H2O,根据得失电子、电荷守恒和物料守恒可知,括号中应是2R2-,所以R元素的最低价为-2价,则最高价为+6价,由此分析解答.
解答 解:由离子方程式:( )+RO32-+6H+=3R+3H2O,根据得失电子、电荷守恒和物料守恒可知,括号中应是R2-,所以R元素的最低价为-2价,则最高价为+6价,所以R元素的最高价氧化物对应的水化物的化学式为H2RO4,
故选B.
点评 本题考查离子方程式的书写和未知物的化合价的推断,注意从守恒的角度解答,解答本题的关键是正确推断未知物的物质的量和化合价,题目难度中等.

练习册系列答案
相关题目
7.下列有关环境问题的说法正确的是( )
①臭氧的体积分数越大的空气越有利于人体健康
②煤燃烧时加入适量的石灰石,可减少废气中SO2的量
③PH在5.6~7.0之间的降水通常称为酸雨
④汽车尾气中含有氮氧化物、碳氧化物、含铅化合物等,严重污染大气.
①臭氧的体积分数越大的空气越有利于人体健康
②煤燃烧时加入适量的石灰石,可减少废气中SO2的量
③PH在5.6~7.0之间的降水通常称为酸雨
④汽车尾气中含有氮氧化物、碳氧化物、含铅化合物等,严重污染大气.
| A. | ①③ | B. | ①④ | C. | ③④ | D. | ②④ |
5.2SO2(g)+O2(g)?SO3(g)是制备硫酸的重要反应,下列叙述中正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 不论以何种方式使反应体系的压强增大,化学反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应到达平衡的时间 | |
| D. | 当该反应到达平衡时,SO2、O2、SO3都存在于反应体系中 |
2.在一密闭容器中进行反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L.当反应达到平衡时,可能存在的数据是( )
| A. | SO2为0.8mol/L,O2为0.4 mol/L | B. | SO2为0.5 mol/L | ||
| C. | SO3为0.8 mol/L | D. | SO2、SO3均为0.3 mol/L |
2.下列电离方程式书写不正确的是( )
| A. | 2H2O?H3O++OH- | B. | H2S?H++HS- | C. | NaHS=Na++HS- | D. | HCO3-=H++CO32- |
3.利用如图所示装置电解1L1mol•L-1的含酚酞的饱和食盐水,下列有关说法正确的是( )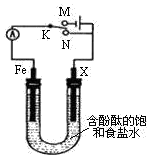

| A. | 电键K置于N处,若X为铜棒,可实现铁棒免受腐蚀 | |
| B. | 电键K置于N处,若X为锌棒,铁棒上发生的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 电键K置于M处,若X为碳棒,碳棒附近溶液变红 | |
| D. | 电键K置于M处,若X为铜棒,可实现在铁棒上镀铜 |
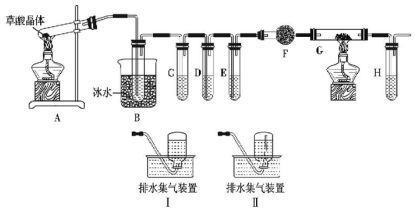
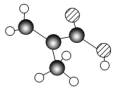 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.