题目内容
8.下列说法或表示方法正确的是( )| A. | 反应物的总能量高于生成物的总能量时,该反应不需要加热就一定能发生 | |
| B. | 由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 | |
| C. | 1molH2SO4与1molBa(OH)2完全中和所放出的热量为中和热 | |
| D. | 101kPa时,H2的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2═H2O(g)△H=-285.8kJ/mol |
分析 A.反应物的总能量高于生成物的总能量时说明反应是放热反应,放热反应也需要引发条件;
B.物质能量越高越活泼;
C.中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量;
D.燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量;
解答 解:A.反应物的总能量高于生成物的总能量时说明反应是放热反应,放热反应也需要引发条件,如铝热反应需要高温引发才能反应,故A错误;
B.由石墨比金刚石稳定可知,金刚石能量高,反应是放热反应,C(金刚石,s)═C(石墨,s)△H<0,故B正确;
C.1molH2SO4与1molBa(OH)2完全中和生成2mol水,反应生成硫酸钡沉淀也会放热,所放出的热量不是中和热,故C错误;
D.101kPa时,H2的燃烧热为285.8kJ/mol,生成水为液体,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2═H2O(l)△H=-285.8kJ/mol,故D错误;
故选B.
点评 本题考查了化学反应能量变化,燃烧热和中和热概念的理解应用,注意硫酸和氢氧化钡反应过程中生成硫酸钡沉淀存在沉淀热,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列溶液中微粒浓度关系一定正确的是( )
| A. | 氨水与氯化铵的pH=7的混合溶液中:[Cl-]>[NH4+] | |
| B. | pH=2的CH3COOH和pH=12的NaOH等体积混合,[OH-]=[H+] | |
| C. | 0.1 mol•L-1的硫酸铵溶液中:[NH4+]+[H+]=2[SO42-]+[OH-] | |
| D. | 0.1 mol•L-1的硫化钠溶液中:[H+]+[Na+]=[OH-]+[HS-]+[S2-] |
19.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类.PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害.下列有关叙述不正确的是( )
| A. | PE、PVC都属于高分子化合物 | |
| B. | 质量相同的乙烯和聚乙烯完全燃烧耗氧量相同 | |
| C. | 乙烯和氯乙烯都是不饱和烃,二者都能使溴水褪色,而PE、PVC不能使溴水褪色 | |
| D. | 回收利用废弃的PE和PVC可减少白色污染,焚烧PVC 保鲜膜会放出有毒气体如HCI |
16.在1mol•L-1的NaOH溶液100mL中,通入1.68L(STP)SO2气体后,在溶液中存在的溶液是( )
| A. | Na2SO3和NaHSO3 | B. | Na2SO3和NaOH | C. | Na2SO3 | D. | NaHSO3 |
3.下列叙述正确的是( )
| A. | 室温下pH=8的CH3COONa溶液中由水电离出的c(OH-)=10-8mol•L-1 | |
| B. | 0.1mol•L-1Ba(HCO3)2溶液中:c(Ba2+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 将pH=2的CH3COOH溶液与pH=12的氨水按体积比1:2混合:c(H+)+c(NH4+)=c(CH3COO-)+c(OH-) | |
| D. | 将足量的BaSO4分别放人①10mLH2O、②20mL0.1mol•L-1Al2(SO4)3溶液、③40mL0.2mol•L-1Na2SO4溶液中至饱和,溶液中c(Ba2+):①>②>③ |
3.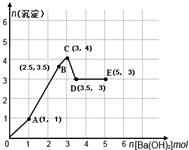 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )| A. | O→A:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | A→B:2Al3++3SO42-+3Ba2++6OH2-=3BaSO4↓+2Al(OH)3↓ | |
| C. | B→C:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O | |
| D. | D→E:NH4++OH-=NH3•H2O |
10.下列关于氧化还原反应的叙述中,正确的是( )
| A. | 有单质参加的反应一定是氧化还原反应 | |
| B. | 一种物质被氧化,必有另一种物质被还原 | |
| C. | 化学反应中,Mg失去2个电子,Al失去3个电子,因此还原性:Al>Mg | |
| D. | 2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ 2FeCl3; Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$ FeS 由此可以判断氧化性:Cl2>S |
7.称取两等份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱,若同温同压下放出相同体积的气体,则消耗的HCl和NaOH的物质的量之比为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:1 |