题目内容
15.下列哪种物质所含氢原子数与0.2mol H3PO4所含氢原子数相等( )| A. | 0.2 mol H2SO4 | B. | 0.4 mol H2O2 | C. | 0.6mol HNO3 | D. | 0.8 mol NaCl |
分析 0.2mol H3PO4所含氢原子的物质的量为:0.2mol×3=0.6mol,氢原子的物质的量与含有氢原子的数目成正比,所含氢原子数与0.2mol H3PO4所含氢原子数相等,说明含有氢原子的物质的量相等,据此进行解答.
解答 解:氢原子的物质的量与含有氢原子的数目成正比,所含氢原子数与0.2mol H3PO4所含氢原子数相等,说明含有氢原子的物质的量为0.6mol,
A.0.2 mol H2SO4中含有H原子的物质的量为:0.2mol×2=0.4mol,故A错误;
B.0.4 mol H2O2中含有H原子的物质的量为:0.4mol×2=0.8mol,故B错误;
C.0.6mol HNO3中含有H原子的物质的量为:0.6mol×1=0.6mol,故C正确;
D.0.8 mol NaCl中不含有H原子,故D错误;
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | SiO2是酸性氧化物,但不能直接与水反应生成H2SiO3 | |
| B. | N2是大气中的主要成分之一,雷雨时可直接转化为NO2 | |
| C. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质活泼 |
| A | B | C | D | |
| 两极材料 | Zn片、石墨 | Cu片、Fe片 | Fe片、石墨 | Fe片、Cu片 |
| 插入溶液 | 稀硫酸 | 浓 HNO3 | FeCl3溶液 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
| A. | SO2 0.4mol/L | B. | SO2 0.25mol/L | ||
| C. | SO2 和SO3均为0.15mol/L | D. | O2 0.2mol/L |
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水:
利用下图所示的实验装置进行实验。
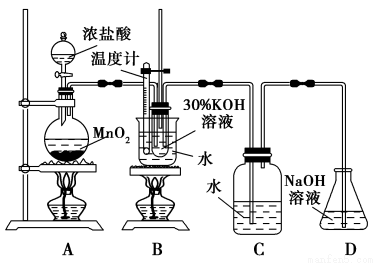
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有________________。
(2)若对调B和C装置的位置,___________(填“能”或 “不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的探究:
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1 KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1 H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______________________。
②设计1号试管实验的作用是_____________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为___________________。
实验三 测定饱和氯水中氯元素的总量:
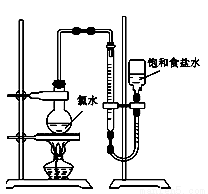
(4)该小组设计的实验方案为:使用如图装置,加热15.0 mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是_____________。(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节): _____________________。
资料:i.次氯酸会破坏酸碱指示剂;ii.次氯酸或氯气可被SO2、H2O2、FeCl2等物质还原成Cl-。
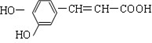
| A. | 咖啡酸可以发生还原、取代、加聚等反应 | |
| B. | 1 mol咖啡酸最多能消耗3 mol的NaHCO3 | |
| C. | 1 mol咖啡酸可与4 mol H2 发生加成反应 | |
| D. | 咖啡酸与FeCl3 溶液可以发生显色反应 |
 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.