题目内容
10.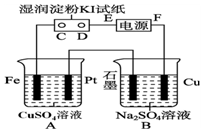 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.(1)E为电源的负极,Fe为阴极.
(2)A中发生反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,
B中发生反应的化学方程式为2Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu(OH)2+H2↑.
(3)在B中观察到的现象是铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成
(4)若此电源为铅蓄电池,电池总反应式为:
Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$PbSO4+2H2O
则放电时:正极的电极反应式是PbO2+2e-+4H++SO42-=PbSO4+2H2O;充电时:阴极的电极反应式是PbSO4+2e-=Pb+SO42-;当外电路通过1mol电子时,理论上负极板的质量增加40g,此时若要使A池中的溶液复原,应加入40g的CuO固体.
分析 通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明C端是阳极,则E是负极,F是正极,铁作阴极,铂丝作阳极,电解硫酸铜溶液时,阴极上铜离子放电,阳极上氢氧根离子放电,
(1)E为电源的 负极,铁电源负极相连,所以Fe为阴极;
(2)A池中为惰性电极电解硫酸铜溶液,反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑;B中铜为阳极电解硫酸钠溶液,发生反应的化学方程式为2Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu(OH)2+H2↑;
(3)在B中观察到的现象是铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成;
(4)电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O,依据电解反应和电池原理分析判断.
解答 解:通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明C端是阳极,则E是负极,F是正极,铁作阴极,铂丝作阳极,电解硫酸铜溶液时,阴极上铜离子放电,阳极上氢氧根离子放电,
(1)E为电源的 负极,铁电源负极相连,所以Fe为阴极,
故答案为:负;阴;
(2)A池中为惰性电极电解硫酸铜溶液,反应的离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑;B中铜为阳极电解硫酸钠溶液,发生反应的化学方程式为:2Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu(OH)2+H2↑,
故答案为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑;2Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu(OH)2+H2↑;
(3)在B中观察到的现象是铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成,
故答案为:铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成;
(4)电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O,负极电解反应为:Pb-2e-+SO42-=PbSO4 ,正极电极反应为:PbO2+2e-+4H++2SO42-=PbSO4+2H2O;放电时:正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;
当外电路通过1mol电子时,依据电子守恒计算理论上负极板增加质量增为:0.5mol×303g/mol-0.5mol×207g/mol=48g,此时若要使A池中的溶液复原,应加入0.5molCuO固体,其质量为:0.5mol×80g/mol=40g,
故答案为:PbO2+2e-+4H++2SO42-=PbSO4+2H2O;PbSO4+2e-=Pb+SO42-;48;40.
点评 本题综合考查电解原理,侧重于考查学生综合运用电解知识的能力,题目难度较大,注意把握电解规律,能正确判断电极方程式,试题有利于提高学生的灵活应用能力.

| A. | 温室效应--减少化石燃料使用,开发清洁能源 | |
| B. | 土壤污染--科学灌溉,合理使用农药和化肥 | |
| C. | 白色污染--杜绝生产塑料袋,从根源上治理 | |
| D. | 水体污染--节约用水,减少污水排放 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑫ | ⑬ |
(2)上述元素中,非金属性最强的元素符号为F,酸性最强的最高价氧化物对应的水化物的化学式为HClO4,能形成两性氢氧化物的元素的符号为Al.
(3)从⑤到⑪的元素中,原子半径最小的元素的符号为Cl.
(4)设计实验证明⑤的单质活动性比⑥的单质活动性强(简述操作过程、现象和结论)将少量Na和Mg分别投入冷水中,金属Na能与水发生剧烈反应,而金属镁反应缓慢,说明Na比Mg活泼.
| A. | 胶粒可以导电 | B. | 胶体有丁达尔效应 | ||
| C. | 胶体粒子大小在1~100nm之间 | D. | 胶体的分散剂为气体 |
| A. | 停止冬季供暖,减少有害物质排放 | |
| B. | 对锅炉和汽车等产生的有害气体和烟尘进行处理 | |
| C. | 退耕还林,改善生态环境 | |
| D. | 寻找新能源,减少化石燃料的使用 |
| 容器编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
| H2 | CO2 | HCOOH | |||
| Ⅰ | 150 | 0.4 | 0.4 | 0.2 | 2 |
| Ⅱ | 150 | 0.8 | 0.8 | t1 | |
| Ⅲ | 0.4 | 0.4 | 0.16 | t2 | |
| A. | 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=0.1mol/(L•min) | |
| B. | 反应达到平衡时,容器Ⅱ所需时间t2<2min | |
| C. | 若只改变一个反应条件,容器Ⅲ可能是加入了合适的催化剂 | |
| D. | 起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2和0.18molHCOOH,则反应向正反应方向进行 |
| A. | K+ 1s22s22p63s23p6 | B. | F 1s22s22p5 | ||
| C. | S2- 1s22s22p63s23p4 | D. | Ar 1s22s22p63s23p6 |
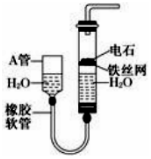 如图,图中的实验装置可用于制取乙炔.
如图,图中的实验装置可用于制取乙炔.