题目内容
10.一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )| A. | c1:c2=3:1 | |
| B. | 平衡时,Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率相等 | |
| D. | c1的取值范围为0 mol/L≤c1≤0.14 mol/L |
分析 X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,利用极值转化,
A.可根据反应转化关系和平衡浓度计算初始浓度关系;
B.达到平衡状态时,正逆反应速率相等;
C.起始量相同,平衡量相同,转化率相同;
D.根据可逆不能完全转化的角度分析.
解答 解:A.设X转化的浓度为x,
X(g)+3Y(g)?2Z(g)
初始:c1 c2c3
转化:x 3x 2x
平衡:0.1moL/L 0.3mol/L 0.08mol/L
所以c1:c2=(x+0.1moL/L):(3x+0.3mol/L)=1:3,故A错误;
B.平衡时,正逆反应速率相等,则Y和Z的生成速率之比为3:2,故B错误;
C.反应前后X、Y气体的浓度比相同符合反应系数之比,所以达到平衡状态时,转化率相同,故C正确;
D.反应为可逆反应,物质不可能完全转化,如反应向逆反应分析进行,则c1>0,如反应向正反应分析进行,则c1<0.14mol•L-1,则:0<c1<0.14mol•L-1,故D错误;
故选C.
点评 本题考查化学平衡的计算,题目难度不大,明确本题注意化学平衡状态的判断方法以及可逆反应的特点为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
1.某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4.在调节溶液pH值时,应选用的试剂是( )
| A. | NaOH | B. | ZnO | C. | Zn | D. | Fe2O3 |
18.下列混合物可以用分液漏斗分离的是( )
| A. | 溴乙烷和水 | B. | 汽油和苯 | C. | 乙醇和水 | D. | 溴苯和苯 |
5.亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如图.下列有关叙述正确的是( )
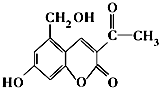

| A. | 亮菌甲素中含有四种官能团 | |
| B. | 亮菌甲素不能与NaHCO3溶液发生反应 | |
| C. | 1 mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2 mol NaOH | |
| D. | 每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子 |
19.能将直馏汽油、裂化汽油、乙醇、四氯化碳四种液体鉴别出来的试剂是( )
| A. | 水 | B. | AgNO3溶液 | C. | 高锰酸钾 | D. | 溴水 |
20.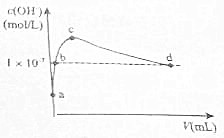 在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )
在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )
 在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )
在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10m01•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7m01•L-1 | |
| C. | c点溶液中:c(K+)>c(HT-)>c(T2-) | |
| D. | d点溶液中:c(K+)=2c(T2-)+c(HT-) |
 已知A~G是几种烃分子的球棍模型,据此回答下列问题:
已知A~G是几种烃分子的球棍模型,据此回答下列问题: .
. .
. .
. .
.