题目内容
1.N2O5是一种新型硝化剂,在一定条件下可发生下列反应:2N2O5 (g)?4NO2(g)+O2 (g)-Q(Q>0)(1)如果上述反应在恒容密闭容器中发生,下列能说明反应达到平衡状态的是ac(选填编号).
a.2v正(N2O5)=v逆(NO2) b.v(NO2)=4v(O2)
c.O2的物质的量的分数保持不变 d.混合气体的密度保持不变
e.每消耗1mol N2O5的同时生成2mol NO2
(2)表为在2L的恒容密闭容器中,反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| n(N2O5)/mol | 10.0 | 7.04 | 4.96 |
(3)若其它条件不变,将温度由T1改变到T2,反应1000s时测得,n( NO2)为9.96mol,则T2<T1(选填“>”、“<”或“=”).
(4)达到平衡后,若其它条件不变,瞬间压缩容器体积至原来的一半,则NO2浓度的变化情况为NO2浓度大于原浓度,小于原浓度的2倍.
分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)根据反应速率v=$\frac{\frac{△n}{V}}{△t}$来计算;
(3)若T2温度高,反应速率快,未到达平衡时,相同时间内N2O5的浓度减小更大,正反应为吸热反应,到达平衡时温度升高,平衡正向移动,N2O5的浓度会减小.而在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则此时N2O5的浓度为5mol/L-$\frac{1}{2}$×4.98mol•L-1=2.51mol/L,高于在T1温度下1000s时测得N2O5的浓度,说明T2温度下反应速率较慢;
(4)根据B可知原平衡时N2O3的浓度,到平衡后其它条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,压强增大一倍,平衡向正反应方向移动.
解答 解:(1)a.2v正(N2O5)=v逆(NO2) 说明正逆反应速率相等,达到了平衡状态,故正确;
b.反应进行到任意状态,正逆反应速率都相等,v(NO2)=4v(O2)均成立,该状态不一定平衡,故错误;
c.O2的物质的量的分数保持不变,说明到了平衡,故正确;
d.混合气体的密度等于质量和体积的比值,密度始终是一个定值,始终保持不变,所以该状态不一定平衡,故错误,
故选ac;
(2)500s内N2O5的分解速率为$\frac{\frac{10.0mol-7.04mol}{2L}}{500s}$=2.96×10-3mol/(L•s),故答案为:2.96×10-3mol/(L•s);
(3)若T2温度高,反应速率快,未到达平衡时,相同时间内N2O5的浓度减小更大,正反应为吸热反应,到达平衡时温度升高,平衡正向移动,N2O5的浓度会减小.而在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则此时N2O5的浓度为5mol/L-0.5×4.98mol•L-1=2.51mol/L,高于在T1温度下1000s时测得N2O5的浓度,说明T2温度下反应速率较慢,故温度T2<T1,故答案为:<;
(4)由B中计算可知原平衡时c(N2O3)=1mol/L,达到平衡后其他条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,若平衡不移动,则c(N2O3)=2mol/L,但压强增大一倍,平衡向正反应方向移动,则c(N2O5)>2mol/L,故答案为:NO2浓度大于原浓度,小于原浓度的2倍.
点评 本题考查化学反应速率计算、化学平衡影响因素、化学平衡平衡常数计算及影响因素等,难度中等,注意理解掌握外界条件对平衡移动的影响.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| 物质 | 杂质 | 试剂 | |
| A | Al2O3 | SiO2 | NaOH溶液 |
| B | Mg | Al | NaOH溶液 |
| C | FeCl2 | FeCl3 | Cu |
| D | NaHCO3 | Na2CO3 | Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 燃烧法可以鉴别羊毛和蚕丝 | |
| B. | 钢铁腐蚀、汽油燃烧均属于缓慢氧化 | |
| C. | 铵态氮肥和熟石灰不能混合使用 | |
| D. | 黄曲霉素可用作抗生素 |
| A. | c(Na+):c(SO32-)<2:1 | |
| B. | c(Na+)=2 c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=2 c(SO32-)+2 c(HSO3-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(SO32-) 与c(Na+) 均增大 |
 )是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
)是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )| A. | 该物质分子式为C10H9O4 | |
| B. | 在酸性条件下水解,水解产物只有一种 | |
| C. | 分子中所有原子处于同一平面 | |
| D. | 1mol化合物X最多能与2molNaOH反应 |
| A. | 标准状况下,密度为d g/L的某气体纯净物其一个分子的质量为22.4d/NA g | |
| B. | 标准状况下,22.4LSO3中的氧原子数为3NA | |
| C. | 5.6 g铁粉与硝酸完全反应,一定失去为0.3NA个电子 | |
| D. | 5.8 g 正丁烷和异丁烷的混合气体中含有共价键的总数为1.3NA |
| A. | 乙烯的结构简式:C2H4 | B. | NaH中氢离子的结构示意图: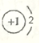 | ||
| C. | NH4I的电子式: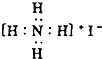 | D. | H2O、CO2的比例模型都可以用 表示 表示 |
