题目内容
14.设NA为阿伏伽德罗常数,下列关于0.2mol/L硝酸钡溶液的叙述,不正确的是( )| A. | 2L溶液中有阴、阳离子总数为0.8NA | |
| B. | 2L溶液中硝酸根离子浓度为0.4 mol/L | |
| C. | 0.5L溶液中钡离子的浓度为0.2mol/L | |
| D. | 0.5L溶液中含有硝酸根离子的总数为0.2NA |
分析 A、求出Ba(NO3)2的物质的量n=CV,然后根据1molBa(NO3)2中含1mol钡离子和2mol硝酸根来分析;
B、NO3-浓度与所取溶液的体积无关;
C、Ba2+浓度与所取溶液的体积无关;
D、根据物质的量n=CV=0.2mol/L×0.5L=0.1mol,然后根据1molBa(NO3)2中含2molNO3-来分析.
解答 解:A、溶液中Ba(NO3)2的物质的量n=CV=0.2mol/L×2L=0.4mol,而1molBa(NO3)2中含1mol钡离子和2mol硝酸根即含3mol离子,则0.4molBa(NO3)2中含1.2mol离子即1.2NA个,故A错误;
B、0.2mol•L-1Ba(NO3)2溶液NO3-浓度为0.4mol/L,与所取溶液的体积无关,故B正确;
C、0.2mol•L-1Ba(NO3)2溶液Ba2+浓度为0.2mol/L,与所取溶液的体积无关,故C正确;
D、0.5L溶液中含有Ba(NO3)2的物质的量n=CV=0.2mol/L×0.5L=0.1mol,而1molBa(NO3)2中含2molNO3-,故0.1molBa(NO3)2中含0.2mol硝酸根,故D正确.
故选A.
点评 本题考查了物质的量的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.应注意的是离子的浓度和所取溶液的体积无关.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
5.下列反应的离子反应方程式书写正确的是( )
| A. | 向碘化钾溶液中加入用硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| B. | 在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-═Cl-+2H++SO42- | |
| C. | 向Ba(OH)2溶液中加入过量NH4HSO4:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+═2Fe3++3H2O |
2.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.Y的核电荷数是Z的核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | X、Y、M三种元素可形成离子化合物 | |
| C. | 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 | |
| D. | Z元素的最高价氧化物的水化物的化学式为HZO4 |
9.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 小苏打--Na2CO3 | B. | 消石灰--Ca (OH)2 | C. | 甲醛--CH3OH | D. | 大理石--CaSO4 |
19.硼有两种天然同位素${\;}_5^{10}B$、${\;}_5^{11}B$,硼元素的相对原子质量为10.80,硼元素中的${\;}_5^{10}B$质量百分比含量的判断正确的是( )
| A. | 略小于20% | B. | 略大于20% | C. | 20% | D. | 80% |
3.假设化学相互作用包括共价键、离子键、范德华力、氢键,下列各组中两种晶体熔化时需要破坏的化学相互作用种类相同的是( )
| A. | C2H5OH(乙醇)、KOH | B. | 金刚石、MgF2 | C. | H2SO4、Na2SO4 | D. | P4和CCl4 |
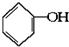 合成
合成 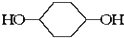 .(部分试剂和反应条件已略去)已知D为1,3-环己二稀
.(部分试剂和反应条件已略去)已知D为1,3-环己二稀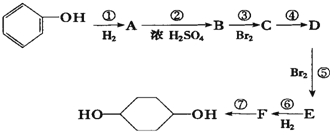

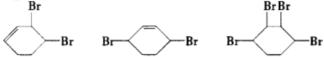 .
.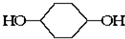 的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3
的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3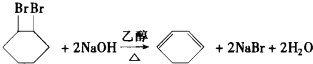 (有机物写结构简式,并注明反应条件)
(有机物写结构简式,并注明反应条件)