题目内容
 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.(1)请分别写出A、B、C、D、E的化学式(如为溶液请填溶质的化学式):
A
(2)写出下列反应的化学方程式(请注明条件):
A+H2O
A+NaOH
B光照分解
考点:无机物的推断,氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:常温下,A是可用来对自来水进行消毒的黄绿色单质气体,判断为Cl2,A、B、C、D、E都含X元素,B为HClO,D为HCl,C为NaCl,E为NaClO,依据推断出的物质结合物质性质回答问题.
解答:
解:依据转化关系图分析,常温下,A是可用来对自来水进行消毒的黄绿色单质气体,判断为Cl2,A、B、C、D、E都含X元素,B为HClO,D为HCl,C为NaCl,E为NaClO;
(1)A为Cl2、B为HClO,C为NaCl,D为HCl,E为NaClO,故答案为:Cl2;HClO;NaCl;HCl;NaClO;
(2)A+H2O反应的化学方程式为:Cl2+H2O=HCl+HClO;A+NaOH的反应化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;B光照分解的化学方程式为:2HClO
2HCl+O2↑;
故答案为:Cl2+H2O=HCl+HClO;Cl2+2NaOH=NaCl+NaClO+H2O;2HClO
2HCl+O2↑.
(1)A为Cl2、B为HClO,C为NaCl,D为HCl,E为NaClO,故答案为:Cl2;HClO;NaCl;HCl;NaClO;
(2)A+H2O反应的化学方程式为:Cl2+H2O=HCl+HClO;A+NaOH的反应化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;B光照分解的化学方程式为:2HClO
| ||
故答案为:Cl2+H2O=HCl+HClO;Cl2+2NaOH=NaCl+NaClO+H2O;2HClO
| ||
点评:本题考查了物质转化关系的分析应用,氯气及其化合物性质的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示,在下列因素中,影响O~t1时间段反应速率的主要因素是( )
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示,在下列因素中,影响O~t1时间段反应速率的主要因素是( )| A、盐酸的浓度 |
| B、镁条的表面积 |
| C、Cl-的浓度 |
| D、溶液的温度 |
在2升的密闭容器中,反应物的物质的量为3mol,经过20s后,它的物质的量变成了1mol,在这20s内它的反应速率为( )
| A、0.1 mol/(L?S) |
| B、0.05mol/( L?min) |
| C、0.05mol/(L?s) |
| D、0.8mol/(L?S) |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,2.8g N2与C2H4的混合气体所含电子数为1.4 NA |
| B、标准状况下,1.12 L NO与1.12O2的混合物中含有的原子数为0.2NA |
| C、25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA |
| D、常温下,1 L 0.1 mol?L-1的NH4NO3溶液中氧原子数为0.3 NA |

 (1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=
(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=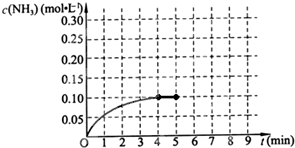 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g);△H<0,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g);△H<0,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: