题目内容
8.在密闭容器中进行X2(g)+3Y2(g)?2Z(g)的反应,其X2、Y2、Z的起始浓度依次为0.1mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,各物质的浓度有可能的是( )| A. | Z=0.5mol/L | B. | Y2=0.5mol/L或X2=0.1mol/L | ||
| C. | Z=0.4mol/L | D. | X2=0.2mol/L或Y2=0.6mol/L |
分析 该反应可能向正反应方向移动也可能向逆反应方向移动,如果向正反应方向移动,则反应物浓度最小、生成物浓度最大,如果向逆反应方向移动,则反应物浓度最大、生成物浓度最小,采用极限法分析解答.
解答 解:该反应可能向正反应方向移动也可能向逆反应方向移动,如果向正反应方向移动,则反应物浓度最小、生成物浓度最大,如果向逆反应方向移动,则反应物浓度最大、生成物浓度最小,假设Z完全转化,完全反应后则c(Y2)=0、c(X2)=(0.1+0.1)mol/L=0.2mol/L、c(Y2)=0.3mol/L+0.3mol/L=0.6mol/L;
假设X2、Y2完全转化为生成物,完全反应后c(Z)=0.4mol/L,
实际上存在平衡状态,所以c(X2)为0.1mol/L~0.2mol/L、c(Y2)为0.3~0.6mol/L、c(Z)在0.2~0.4mol/L,
故选B.
点评 本题考查化学平衡建立过程,明确可逆反应特点是解本题关键,利用极限法分析解答即可,题目难度不大.

练习册系列答案
相关题目
19.在容积不变的密闭容器中存在如下反应:2A(g)+B(s)?2C(g)△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )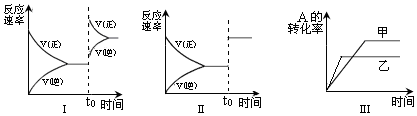

| A. | 图I研究的是t0时刻增大A的浓度对反应速率的影响 | |
| B. | 图II研究的是t0时刻加入催化剂或通入氦气使压强增大后对反应速率的影响 | |
| C. | 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高 | |
| D. | 图III研究的是温度对化学平衡的影响,且乙的温度较高 |
16.下列鉴别物质的方法不能达到目的是( )
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | NO2和溴蒸气都呈红棕色,用水可鉴别NO2和溴蒸气 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和FeSO4溶液 | |
| D. | 用丁达尔效应鉴别NaCl溶液和KCl溶液 |
3.现有X、Y、Z三种金属,已知:①X+YCl2═XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应.这三种金属的活动性由弱到强的顺序是( )
| A. | Y<Z<X | B. | X<Y<Z | C. | Z<Y<X | D. | X<Z<Y |
20.德国化学家F.Haber利用N2和 H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的微观历程及能量变化的示意图如下,用 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )

 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
| A. | 催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 | |
| D. | 使用催化剂,合成氨反应放出的热量减少 |
18.工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下处理措施和方法类别都正确的是( )
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 含Cr2O72-废水 | 加FeSO4沉降 | 物理法 |
| B | 含纯碱的废水 | 加石灰水反应 | 化学法 |
| C | 含Cu2+等重金属离子的废水 | 加硫酸盐沉降 | 化学法 |
| D | 含复杂有机物的废水 | 通过微生物代谢 | 生物法 |
| A. | A | B. | B | C. | C | D. | D |
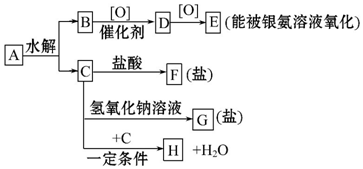
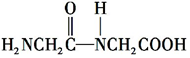 +H2O.
+H2O.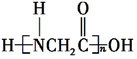 +(n-1)H2O.
+(n-1)H2O.