题目内容
在氯水中存在三个平衡,使得氯水具有多样性:
①Cl2+H2O?HCl+HClO ②HClO?H++ClO- ③H2O?H++OH-
(1)氯水中存在的粒子是 ;
(2)历史上自来水曾用氯气来消毒,起作用的成分是
(3)在氯水中加入碳酸钙粉末, 浓度升高(不考虑体积的变化)
(4)将氯水加入到氯化亚铁溶液中, 将亚铁离子氧化.
①Cl2+H2O?HCl+HClO ②HClO?H++ClO- ③H2O?H++OH-
(1)氯水中存在的粒子是
(2)历史上自来水曾用氯气来消毒,起作用的成分是
(3)在氯水中加入碳酸钙粉末,
(4)将氯水加入到氯化亚铁溶液中,
考点:氯、溴、碘及其化合物的综合应用
专题:
分析:(1)根据氯水中存在的平衡知,氯水中存在的微粒有Cl2、H2O、HClO、H+、ClO-、Cl-、OH-;
(2)HClO属于弱酸,但具有强氧化性,能杀菌消毒;
(3)盐酸酸性大于碳酸,所以盐酸和碳酸钙反应生成CO2、H2O、CaCl2,促进氯气和水反应,次氯酸酸性小于碳酸,所以HClO和碳酸钙不反应;
(4)Cl2、HClO具有强氧化性,能将亚铁离子氧化生成铁离子.
(2)HClO属于弱酸,但具有强氧化性,能杀菌消毒;
(3)盐酸酸性大于碳酸,所以盐酸和碳酸钙反应生成CO2、H2O、CaCl2,促进氯气和水反应,次氯酸酸性小于碳酸,所以HClO和碳酸钙不反应;
(4)Cl2、HClO具有强氧化性,能将亚铁离子氧化生成铁离子.
解答:
解:(1)水、次氯酸都是弱电解质,在水溶液中存在电离平衡,则氯水中存在的微粒有Cl2、H2O、HClO、H+、ClO-、Cl-、OH-,
故答案为:Cl2、H2O、HClO、H+、ClO-、Cl-、OH-;
(2)HClO属于弱酸,但具有强氧化性,病毒属于蛋白质,HClO能使蛋白质变性而杀菌消毒,故答案为:HClO;
(3)盐酸酸性大于碳酸,所以盐酸和碳酸钙反应生成CO2、H2O、CaCl2,2HCl+CaCO3=CO2↑+H2O+CaCl2,促进氯气和水反应,HClO酸性小于碳酸,所以HClO和CaCO3不反应,所以溶液中HClO浓度增大,故答案为:HClO;
(4)Cl2、HClO具有强氧化性,能将亚铁离子氧化生成铁离子,所以氯水中能将亚铁离子氧化的粒子是Cl2、HClO,故答案为:Cl2、HClO.
故答案为:Cl2、H2O、HClO、H+、ClO-、Cl-、OH-;
(2)HClO属于弱酸,但具有强氧化性,病毒属于蛋白质,HClO能使蛋白质变性而杀菌消毒,故答案为:HClO;
(3)盐酸酸性大于碳酸,所以盐酸和碳酸钙反应生成CO2、H2O、CaCl2,2HCl+CaCO3=CO2↑+H2O+CaCl2,促进氯气和水反应,HClO酸性小于碳酸,所以HClO和CaCO3不反应,所以溶液中HClO浓度增大,故答案为:HClO;
(4)Cl2、HClO具有强氧化性,能将亚铁离子氧化生成铁离子,所以氯水中能将亚铁离子氧化的粒子是Cl2、HClO,故答案为:Cl2、HClO.
点评:本题考查氯水及其性质,明确氯水中成分是解本题关键,根据存在的平衡确定存在的微粒,知道各种微粒的性质,一般考查氯水成分的强氧化性,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
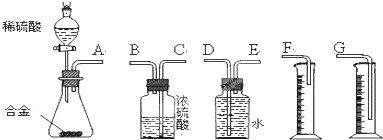
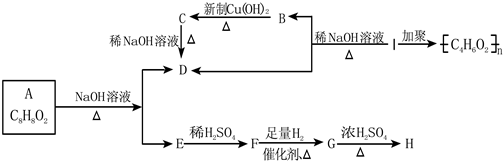 其中F能与FeCl3溶液显紫色,I为一种不饱和酯.
其中F能与FeCl3溶液显紫色,I为一种不饱和酯.