题目内容
一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1160.0kJ?mol-1 H2O(l)=H2O(g)△H=+44.0kJ?mol-1 若取一定量的CH4和NO投入到恒容的密闭容器中,下列有关说法正确的是( )
| A、当该反应体系平均分子质量不变时,反应体系达到平衡 |
| B、当容器中每生成1 mol H2O(1)时,放出的能量为536.0kJ |
| C、升高温度,正反应速率加快,平衡常数减小 |
| D、加入高效催化剂可以一定程度上提高NO转化率 |
考点:化学平衡移动原理,化学反应速率的影响因素
专题:
分析:A、根据反应体系平均分子质量M=
结合m和n的变化来回答;
B、根据液态水水变为水蒸气要吸收能量,据盖斯定律来计算回答;
C、升高温度,化学反应速率加快,对于放热反应,K减小;
D、加入催化剂不能改变化学平衡的移动方向,只能加快反应速率.
| m |
| n |
B、根据液态水水变为水蒸气要吸收能量,据盖斯定律来计算回答;
C、升高温度,化学反应速率加快,对于放热反应,K减小;
D、加入催化剂不能改变化学平衡的移动方向,只能加快反应速率.
解答:
解:A、由于反应前后气体的分子数不变,质量变,所以体系平均分子质量始终是不变的,即M不变不一定平衡,故A错误;
B、根据盖斯定律计算得到:当容器中每生成1 mol H2O(1)时,焓变为
kJ/mol=-624kJ/mol,故B错误;
C、升高温度,正反应速率加快,该反应是放热反应,所以平衡常数减小,故C正确;
D、加入高效催化剂可以一定程度上加快反应速率,不能改变化学平衡的移动方向,即不能提高NO转化率,故D错误.
故选C.
B、根据盖斯定律计算得到:当容器中每生成1 mol H2O(1)时,焓变为
| -1160-88 |
| 2 |
C、升高温度,正反应速率加快,该反应是放热反应,所以平衡常数减小,故C正确;
D、加入高效催化剂可以一定程度上加快反应速率,不能改变化学平衡的移动方向,即不能提高NO转化率,故D错误.
故选C.
点评:本题涉及化学平衡的判断、影响化学反应速率和平衡移动的因素以及影响平衡常数变化的因素,综合性强,难度不大.

练习册系列答案
相关题目
从海水中提取溴常用的一种工艺涉及以下过程:则正确的步骤为( )
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr.
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr.
| A、②①③④ | B、①②③④ |
| C、③②①④ | D、②①④③ |
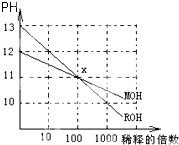 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )| A、等PH的MOH和ROH溶液,稀释相同倍数,ROH 溶液的PH略大 |
| B、稀释前,c(ROH)=10c(MOH) |
| C、常温下pH之和为14的醋酸和ROH溶液等体积混合,溶液呈碱性 |
| D、在x点,c(M+)=c(R+) |
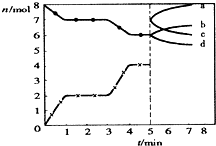 高温下进行反应:C(s)+CO2(g)?2CO(g)△H=xkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图:下列说法正确的是( )
高温下进行反应:C(s)+CO2(g)?2CO(g)△H=xkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图:下列说法正确的是( )A、2min时,
| ||||
| B、0~lmin,v(CO)=1 mol/(L?min);1~3min时,v(CO)=v(CO2) | ||||
| C、3min时温度由T1升高到T2,则x>O | ||||
| D、5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化 |
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )

| A、a电极是负极 |
| B、电子从b电极流向a电极 |
| C、在电池工作中,a电极附近pH值降低 |
| D、b电极的电极反应为:4OH--4e-═2H2O+O2↑ |
下列有关托盘天平的使用的叙述不正确的是( )
| A、称量前先调节托盘天平的零点 |
| B、潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 |
| C、用托盘天平只能称量至0.1g |
| D、称量时左盘放被称量物,右盘放砝码 |