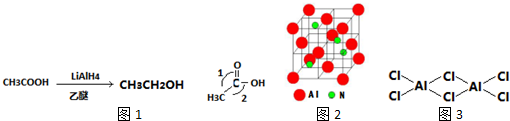
题目内容
14. 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.(1)基态硅原子的电子排布式:1s22s22p63s23p2.
(2)有一类组成最简单的有机硅化合物叫硅烷.硅烷的组成、结构与相应的烷烃相似.硅烷中硅采取sp3杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是硅烷的相对分子质量越大,分子间范德华力越强.
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为As<Se<Br.(用元素符号表示)
(4)气态SeO3分子的立体构型为平面三角形,与SeO3互为等电子体的一种离子为CO32-或NO3-(填化学式).
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为1:3;若该晶体的晶胞棱长为a pm,则该合金密度为$\frac{\frac{197+64×3}{{N}_{A}}}{(a×1{0}^{-10}){\;}^{3}}$g/cm3.(列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
分析 (1)硅是14号元素,根据原子核外电子排布规律可以写出电子排布式;
(2)根据硅烷的分子式得出,硅烷的通式为:SinH2n+2,又硅烷的组成、结构与相应的烷烃相似,所以硅烷中硅采取sp3杂化方式;根据SinH2n+2都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,据此答题;
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右电负性增大;
(4)气态SeO3分子中中心原子的价层电子对数可以判断分子构型;根据等电子体要求原子总数相同,价电子数相同来确定;
(5)利用均摊法计算两种金属原子个数之比,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)硅是14号元素,根据原子核外电子排布规律可以写出电子排布式为:1s22s22p63s23p2;
故答案为:1s22s22p63s23p2;
(2)根据硅烷的分子式得出,硅烷的通式为:SinH2n+2,又硅烷的组成、结构与相应的烷烃相似,所以硅烷中硅采取sp3杂化方式;硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,硅烷的相对分子质量越大,分子间范德华力越强;
故答案为:sp3;硅烷的相对分子质量越大,分子间范德华力越强;
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右电负性增大,故电负性:As<Se<Br,
故答案为:As<Se<Br;
(4)气态SeO3分子中中心原子的价层电子对数为$\frac{6+0}{2}$=3,无孤电子对,所以分子构型为平面三角形,又等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-;
故答案为:平面三角形;CO32-或NO3-;
(5)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×$\frac{1}{8}$=1,Cu原子个数=6×$\frac{1}{2}$=3,所以该合金中Au原子与Cu原子个数之比=1:3,晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=$\frac{\frac{197+64×3}{{N}_{A}}}{(a×1{0}^{-10}){\;}^{3}}$g•cm-3;
故答案为:1:3;$\frac{\frac{197+64×3}{{N}_{A}}}{(a×1{0}^{-10}){\;}^{3}}$g•cm-3;
点评 本题考查了物质结构与性质,主要涉及电子排布式、电负性、分子构型的判断、晶胞的计算等,题目难度中等,注意把握晶体的有关计算方法.

 阅读快车系列答案
阅读快车系列答案| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | X分别与Y、Z、W所形成的化合物均为共价化合物 | |
| D. | X与Y所形成的化合物的沸点可能高于X与Z所形成的化合物 |
| A. | 如果汽油、煤油等可燃物着火,应立即用水扑灭 | |
| B. | 在点燃易燃气体前,必须检验气体的纯度 | |
| C. | 为防止试管破裂,加热固体高锰酸钾制氧气时,试管口应略向下倾斜 | |
| D. | 萃取操作时,应选择可以和原溶剂不互溶的萃取剂 |
| A. | Cl2在反应中不一定只作氧化剂 | |
| B. | 在氧化还原反应中,1mol Cl2一定得到 2 mole- | |
| C. | 用pH试纸测得某饱和氯水的pH=2.3 | |
| D. | 除去HCl气体中的Cl2,可将气体通过盛饱和食盐水的洗气瓶 |
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 在1 L 2 mol•L-1 Fe(OH)3胶体中,含有的Fe(OH)3胶体粒子数为2NA | |
| C. | 在Fe(OH)3胶体中滴入少量稀硫酸将有沉淀产生 | |
| D. | 淀粉胶体中含有少量的NaCl,可用适量AgNO3溶液除去 |
①纯铁不容易生锈 ②钠着火用水扑灭 ③铝在空气中耐腐蚀,所以铝是不活泼金属 ④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金 ⑥KSCN溶液可以检验Fe3+离子 ⑦Al和Fe都能与某些氧化物反应.
| A. | ①②⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤⑦ | D. | ①④⑤⑥⑦ |
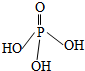 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na5P3O10 | |
| C. | 以磷酸钠为原料通过化合反应也能生成三聚磷酸钠 | |
| D. | 多聚磷酸的结构可表示为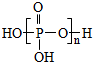 |