题目内容
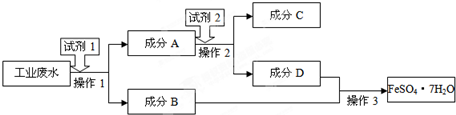
某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体,以探索工业废料的再利用.其实验过程如下:

(1)合金与足量烧碱反应的离子方程式 .
(2)由滤液A制AlCl3溶液的途径有两条(如图1所示),你认为合理的途径是 ,理由是 .
(3)下表是绿矾的溶解度表:(单位克)
从滤液E中得到绿矾晶体的实验操作为蒸发浓缩、 、过滤.此步骤中过滤要采用抽滤,与一般过滤相比抽滤的主要优点是 .但过滤氢氧化铝沉淀却不能采用抽滤,原因可能是 .若抽滤装置如图2所示,该装置中的错误之处是 ;抽滤完毕或中途需停止抽滤时,应先 ,然后
(4)在滤渣B中加入稀硫酸,即使在常温下反应也非常快,你认为最主要的原因是 .
(5)该小组某成员听说大部分化妆品中均有甘油,只用上面涉及的物质,能否验证某化妆品中是否含有甘油? (能或不能).若能,验证是否含甘油的现象是 .

(1)合金与足量烧碱反应的离子方程式
(2)由滤液A制AlCl3溶液的途径有两条(如图1所示),你认为合理的途径是
(3)下表是绿矾的溶解度表:(单位克)
| 温度(℃) | 10 | 20 | 30 | 40 | 50 |
| 溶解度 | 36 | 48 | 60 | 73 | 87 |
(4)在滤渣B中加入稀硫酸,即使在常温下反应也非常快,你认为最主要的原因是
(5)该小组某成员听说大部分化妆品中均有甘油,只用上面涉及的物质,能否验证某化妆品中是否含有甘油?
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:Al、Fe、Cu三种金属中,加入碱溶液后只有Al溶解,生成NaAlO2溶液,若在此溶液中加入足量的盐酸,因盐酸为强酸,可以溶解生成的氢氧化铝,则继续反应生成AlCl3溶液,反应离子方程式为:AlO2-+4H+═Al3++2H2O,而第二种途径通入气体后生成沉淀,与盐酸反应生成AlCl3,由此判断生成的沉淀为氢氧化铝,则确定通入的气体在水中生成弱酸,则判断为CO2气体.不溶于碱溶液的金属Fe和Cu,加入足量稀硫酸后,Fe溶解生成硫酸亚铁溶液,溶液通过蒸发浓缩后冷却结晶可得到绿矾晶体,不溶于酸的铜则可在通入氧气的条件下与硫酸反应生成胆矾.若三种金属先与酸反应,则Fe和Al均会消耗酸,另外还有将Fe2+与Al3+分离,加入过量的碱,因此步骤更多.
(1)根据铝与碱反应生成偏铝酸钠和氢气;
(2)根据物质的性质结合框图转化关系和所得产品进行解答;
(3)从滤液E中得到绿矾晶体的实验操作是蒸发浓缩,冷却结晶过滤洗涤;优点是①过滤速度快②得到的固体比较干燥;过滤氢氧化铝沉淀却不能采用抽滤,原因可能是氢氧化铝沉淀属胶状固体,易堵塞布氏漏斗;图2中的两处错误为布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;吸滤完毕时,应先拆下连接抽气泵间的橡皮管,然后关闭水龙头,其原因是防止倒吸;
(4)从构成原电池的条件来分析;
(5)根据用新制备的氢氧化铜悬浊液检验甘油的方法来判断.
(1)根据铝与碱反应生成偏铝酸钠和氢气;
(2)根据物质的性质结合框图转化关系和所得产品进行解答;
(3)从滤液E中得到绿矾晶体的实验操作是蒸发浓缩,冷却结晶过滤洗涤;优点是①过滤速度快②得到的固体比较干燥;过滤氢氧化铝沉淀却不能采用抽滤,原因可能是氢氧化铝沉淀属胶状固体,易堵塞布氏漏斗;图2中的两处错误为布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;吸滤完毕时,应先拆下连接抽气泵间的橡皮管,然后关闭水龙头,其原因是防止倒吸;
(4)从构成原电池的条件来分析;
(5)根据用新制备的氢氧化铜悬浊液检验甘油的方法来判断.
解答:
解:(1)因铝与碱反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,则离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)途径1发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O,会引入盐酸,氯化钠杂质;
故答案为:2合理;途径2制得的氯化铝溶液纯度高,途径1制取的AlCl3溶液中混有NaCl杂质;
(3)从滤液E中得到绿矾晶体的实验操作是蒸发浓缩,冷却结晶过滤洗涤;优点是①过滤速度快②得到的固体比较干燥;过滤氢氧化铝沉淀却不能采用抽滤,原因可能是氢氧化铝沉淀属胶状固体,易堵塞布氏漏斗;图2中的两处错误为布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;吸滤完毕时,应先拆下连接抽气泵间的橡皮管,然后关闭水龙头,其原因是防止倒吸;
故答案为:冷却结晶;①过滤速度快②得到的固体比较干燥;氢氧化铝沉淀属胶状固体,易堵塞布氏漏斗;布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;拆下连接抽气泵间的橡皮管;关闭水龙头;
(4)滤渣B中加入稀硫酸,刚好构成铜-铁-酸构成原电池反应,反应速度快,故答案为:铜-铁-酸构成原电池反应,反应速度快;
(5)用新制备的氢氧化铜悬浊液检验甘油,若出现绛蓝色,则说明有甘油存在;故答案为:能;在少量样品中加入新制备的氢氧化铜悬浊液,若出现绛蓝色,则说明有甘油存在.
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)途径1发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O,会引入盐酸,氯化钠杂质;
故答案为:2合理;途径2制得的氯化铝溶液纯度高,途径1制取的AlCl3溶液中混有NaCl杂质;
(3)从滤液E中得到绿矾晶体的实验操作是蒸发浓缩,冷却结晶过滤洗涤;优点是①过滤速度快②得到的固体比较干燥;过滤氢氧化铝沉淀却不能采用抽滤,原因可能是氢氧化铝沉淀属胶状固体,易堵塞布氏漏斗;图2中的两处错误为布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;吸滤完毕时,应先拆下连接抽气泵间的橡皮管,然后关闭水龙头,其原因是防止倒吸;
故答案为:冷却结晶;①过滤速度快②得到的固体比较干燥;氢氧化铝沉淀属胶状固体,易堵塞布氏漏斗;布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;拆下连接抽气泵间的橡皮管;关闭水龙头;
(4)滤渣B中加入稀硫酸,刚好构成铜-铁-酸构成原电池反应,反应速度快,故答案为:铜-铁-酸构成原电池反应,反应速度快;
(5)用新制备的氢氧化铜悬浊液检验甘油,若出现绛蓝色,则说明有甘油存在;故答案为:能;在少量样品中加入新制备的氢氧化铜悬浊液,若出现绛蓝色,则说明有甘油存在.
点评:本题是对物质的分离和提纯知识点的考查,题目难度比较大,可以根据所学的知识进行.

练习册系列答案
相关题目
下列关于中和滴定实验的叙述正确的是( )
| A、锥形瓶用待测溶液润洗 |
| B、碱式滴定管可不用碱液润洗 |
| C、盐酸滴定氢氧化钠溶液时可以用甲基橙作指示剂 |
| D、滴定操作时,眼睛应注视滴定管中液面的变化 |
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1mol,下列说法一定正确的是( )
| A、b=2 |
| B、容器中一定没有残余的CO2和水蒸气 |
| C、a≥b |
| D、反应中转移的电子数一定为2NA |


 氧化铜是一种黑色固体,可溶于稀硫酸.某化学兴趣小组为探究稀硫酸中哪种粒子能使氧化铜溶解,该小组同学提出如下假设:
氧化铜是一种黑色固体,可溶于稀硫酸.某化学兴趣小组为探究稀硫酸中哪种粒子能使氧化铜溶解,该小组同学提出如下假设: