题目内容
工业上常常利用物质的酸碱性分离混合物.某一混合物含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如图.
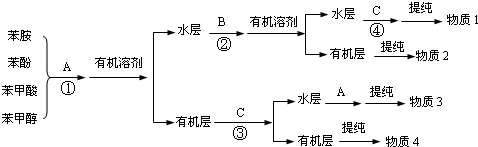
已知:(1)苯胺(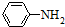 )有弱碱性,可与盐酸等反应生成盐;
)有弱碱性,可与盐酸等反应生成盐;
(2)常温下,苯胺、苯酚、苯甲酸、苯甲醇微溶于水,但均易溶于有机溶剂.回答下列问题:
(1)写名称:物质2是 ,物质4是 .
(2)写出A、C的化学式:A ,C .
(3)写出反应②的化学方程式: .

已知:(1)苯胺(
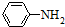 )有弱碱性,可与盐酸等反应生成盐;
)有弱碱性,可与盐酸等反应生成盐;(2)常温下,苯胺、苯酚、苯甲酸、苯甲醇微溶于水,但均易溶于有机溶剂.回答下列问题:
(1)写名称:物质2是
(2)写出A、C的化学式:A
(3)写出反应②的化学方程式:
考点:物质分离、提纯的实验方案设计
专题:
分析:苯酚、苯甲酸呈酸性,苯胺呈碱性,苯甲醇为中性,可先加氢氧化钠或碳酸钠溶液,苯酚、苯甲酸与氢氧化钠反应生成溶于水的盐,则水层中含有苯酚钠、苯甲酸钠,在溶液中通入二氧化碳气体,可得到苯酚,分离后在水中加入盐酸可得到苯甲酸,则A为NaOH溶液,B为二氧化碳,C为盐酸,物质1为苯甲酸,物质2为苯酚;苯甲醇、苯胺中加入盐酸,苯胺生成盐,溶于水,在水层中加入氢氧化钠可得到苯胺;则物质3为苯胺,物质4为苯甲醇.
解答:
解:苯甲醇和苯胺均与不与碱液反应,因此首先用NaOH溶液或Na2CO3溶液将四种物质分为两类;苯甲醇、苯甲酸、苯胺微溶于水,因此有机溶剂萃取后水层是苯甲酸钠和苯酚钠的混合液,而有机层是苯甲醇和苯胺的混合液;苯胺显碱性,因此可以加入盐酸转化为盐与苯甲醇分离,即物质4是苯甲醇;苯胺形成的盐再与氢氧化钠反应又转化为苯胺,即物质3是苯胺;根据酸性强弱顺序可知,向苯酚钠和苯甲酸钠的混合液中通入CO2即可将苯酚转化为苯酚,即物质2是苯酚;盐酸的酸性强于苯甲酸,所以向苯甲酸钠的溶液中加入盐酸可以生成苯甲酸,即物质1是苯甲酸,
(1)根据以上分析可知物质2为苯酚,物质4为苯甲醇,故答案为:苯酚;苯甲醇;
(2)A为碱性溶液,可以为NaOH溶液或Na2CO3溶液;C 强酸,可以用盐酸,化学式为HCl,
故答案为:NaOH(或Na2CO3);HCl;
(3)反应②加入的B为二氧化碳气体,苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠,反应得到化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
(1)根据以上分析可知物质2为苯酚,物质4为苯甲醇,故答案为:苯酚;苯甲醇;
(2)A为碱性溶液,可以为NaOH溶液或Na2CO3溶液;C 强酸,可以用盐酸,化学式为HCl,
故答案为:NaOH(或Na2CO3);HCl;
(3)反应②加入的B为二氧化碳气体,苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠,反应得到化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
点评:本题考查了物质的分离、提纯实验方案的设计,题目难度中等,试题侧重于学生的分析能力和实验能力的考查,把握各物质的性质的异同为解答关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用98%的浓硫酸(密度为1.84g/cm3)配制100mL 1mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④电子天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,配制中所需仪器的正确的是( )
| A、②③⑤⑥⑦ | B、②⑤⑦⑥ |
| C、①③⑤⑥⑦ | D、③④⑤⑥⑦ |
下列各物质中所有碳原子不在同一平面的是( )
| A、甲苯 | B、丙烯 |
| C、乙烯 | D、1-丁烯 |
下列物质不能通过化合反应直接制得的是( )
| A、FeCl2 |
| B、NaHSO3 |
| C、Cu(OH)2 |
| D、Na2O2 |
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1mol,下列说法一定正确的是( )
| A、b=2 |
| B、容器中一定没有残余的CO2和水蒸气 |
| C、a≥b |
| D、反应中转移的电子数一定为2NA |
下列物质在水溶液中,存在电离平衡的是( )
| A、Ca(OH)2 |
| B、CH3COOH |
| C、BaSO4 |
| D、CH3COONa |
 氧化铜是一种黑色固体,可溶于稀硫酸.某化学兴趣小组为探究稀硫酸中哪种粒子能使氧化铜溶解,该小组同学提出如下假设:
氧化铜是一种黑色固体,可溶于稀硫酸.某化学兴趣小组为探究稀硫酸中哪种粒子能使氧化铜溶解,该小组同学提出如下假设: