题目内容
14.某工厂变废为宝,探究用废硫酸等来制取所需产品.现有废硫酸4.9t(H2SO4的质量分数为20%),与足量废铁屑反应来制取硫酸亚铁,同时将生成的全部氢气通入足量氧化铜中并加热(H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O),请计算:理论上生成的全部氢气的物质的量和最多可生产的铜的质量.分析 根据铁与硫酸,氢气与氧化铜的反应的化学方程式,可以得出硫酸与铜的关系式进行相关的计算.
解答 解:m(H2SO4)=4.9×106×20%g=9.8×105g
Fe+H2SO4=FeSO4+H2↑
98g 1mol
9.8×105g n
$\frac{98g}{9.8×1{0}^{5}g}$=$\frac{1mol}{n}$,解得n=104mol,
根据方程式Fe+H2SO4=FeSO4+H2↑,H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O
可得关系式:H2SO4~H2~Cu
1 1
104 104
则m(Cu)=104mol×64g/mol=0.64 t.
答:理论上生成的全部氢气的物质的量104mol,最多可生产的铜的质量0.64 t.
点评 本题主要考查化学方程式的相关计算,题目难度不大.

练习册系列答案
相关题目
14.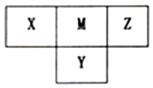 短周期元素X、Y、Z、M在周期表中所处的位置如图所示,四种元素原子的质子数之和为36.下列说法不正确的是( )
短周期元素X、Y、Z、M在周期表中所处的位置如图所示,四种元素原子的质子数之和为36.下列说法不正确的是( )
 短周期元素X、Y、Z、M在周期表中所处的位置如图所示,四种元素原子的质子数之和为36.下列说法不正确的是( )
短周期元素X、Y、Z、M在周期表中所处的位置如图所示,四种元素原子的质子数之和为36.下列说法不正确的是( )| A. | X与Z形成的三原子分子的电子式为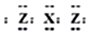 | |
| B. | 简单氢化物稳定性Z>M>Y | |
| C. | X、Y、M分别与Z可形成多种二元共价化合物 | |
| D. | 最高价氧化物的水化物的酸性M>Y>X |
9.现有两种有机化合物,不论以何种比例混合,只要物质的量之和不变,则完全燃烧时消耗氧气和生成的水的物质的量也不变.则它们可能是( )
| A. | 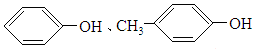 | B. | 甲苯和甘油(丙三醇) | ||
| C. | CH4、C2H4O2 | D. | C3H4、C3H6O |
19. 实验室需要制备、干燥和收集:①CO2、②Cl2、③SO2、④O2、⑤NO、⑥NO2、⑦H2、⑧NH3,其中能用如图所示装置进行实验的是( )
实验室需要制备、干燥和收集:①CO2、②Cl2、③SO2、④O2、⑤NO、⑥NO2、⑦H2、⑧NH3,其中能用如图所示装置进行实验的是( )
 实验室需要制备、干燥和收集:①CO2、②Cl2、③SO2、④O2、⑤NO、⑥NO2、⑦H2、⑧NH3,其中能用如图所示装置进行实验的是( )
实验室需要制备、干燥和收集:①CO2、②Cl2、③SO2、④O2、⑤NO、⑥NO2、⑦H2、⑧NH3,其中能用如图所示装置进行实验的是( )| A. | ①②③④⑥ | B. | ⑤⑦⑧ | C. | ①②③④⑤⑥ | D. | ①②③④⑤⑥⑦⑧ |
6.据有关资料显示,在独居石(一种共生矿,化学成分为Ce、La、Nb…的磷酸盐)中,查明有尚未命名的116,124,126号元素.试判断116号元素应位于周期表中的( )
| A. | 第6周期,第ⅣA族 | B. | 第7周期,第ⅥA族 | C. | 第7周期,第ⅣA族 | D. | 第8周期,第ⅥA族 |
3.海带提碘实验中,不会用到的装置是( )
| A. |  | B. |  | C. |  | D. |  |
4.有些科学家提出硅是“21世纪的能源”,下列关于硅及其化合物的说法正确的是( )
| A. | 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| D. | 陶瓷是人类应用很早的硅酸盐材料 |
 (一氯环己烷)$\stackrel{②}{→}$
(一氯环己烷)$\stackrel{②}{→}$ $→_{③}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{④}{→}$
$→_{③}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{④}{→}$

