题目内容
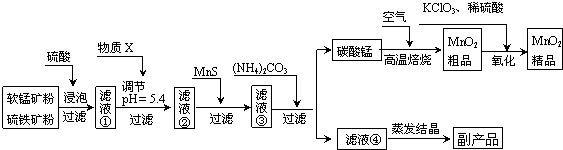
三氧化二镍是一种重要的电子元件材料、蓄电池材料.工业上利用含镍废料(镍铁钙镁合金为主)制取草酸镍,再高温煅烧草酸镍制取三氧化二镍.已知草酸的钙、镁、镍盐难溶于水.根据下列工艺流程示意图回答问题.

(1)生产过程中多次进行过滤.实验室进行过滤操作中用到玻璃棒,玻璃棒的作用是 .
(2)加入过氧化氢后缓慢加入碳酸钠溶液调pH至4.0~4.5左右,加入碳酸钠溶液的作用是 .再加入NH4F的目的是 .
(3)草酸镍(NiC2O4?2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得三氧化二镍,同时获得一种混合气体.写出草酸镍受热分解的化学方程式 .
(4)工业上还可用电解法制取三氧化二镍.用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解.电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍.写出ClO-氧化Ni(OH)2生成三氧化二镍的离子方程式 .a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 .
(5)电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol该物质中含有0.5mol结晶水.取该化合物20.2g进行充分加热,而获得三氧化二镍固体和0.2mol水,则该结晶水合物的化学式为 .

(1)生产过程中多次进行过滤.实验室进行过滤操作中用到玻璃棒,玻璃棒的作用是
(2)加入过氧化氢后缓慢加入碳酸钠溶液调pH至4.0~4.5左右,加入碳酸钠溶液的作用是
(3)草酸镍(NiC2O4?2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得三氧化二镍,同时获得一种混合气体.写出草酸镍受热分解的化学方程式
(4)工业上还可用电解法制取三氧化二镍.用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解.电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍.写出ClO-氧化Ni(OH)2生成三氧化二镍的离子方程式
(5)电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol该物质中含有0.5mol结晶水.取该化合物20.2g进行充分加热,而获得三氧化二镍固体和0.2mol水,则该结晶水合物的化学式为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)过滤时用玻璃棒进行引流;
(2)过氧化氢氧化亚铁离子为铁离子,依据电荷守恒和原子守恒,加入Na2CO3溶液调pH至4.0?4.5,促进铁离子水解形成氢氧化铁沉淀;氟化钙、氟化镁难溶于水;
(3)草酸镍(NiC2O4?2H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2)生成Ni2O3、CO、CO2,再利用化合价升降相等配平;
(4)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确;依据化学方程式和元素守恒计算得到;
(5)依据(4)的计算结果和原子守恒分析写出化学式.
(2)过氧化氢氧化亚铁离子为铁离子,依据电荷守恒和原子守恒,加入Na2CO3溶液调pH至4.0?4.5,促进铁离子水解形成氢氧化铁沉淀;氟化钙、氟化镁难溶于水;
(3)草酸镍(NiC2O4?2H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2)生成Ni2O3、CO、CO2,再利用化合价升降相等配平;
(4)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确;依据化学方程式和元素守恒计算得到;
(5)依据(4)的计算结果和原子守恒分析写出化学式.
解答:
解:(1)过滤时用玻璃棒进行引流,故答案为:引流;
(2)加双氧水的目的是把Fe2+氧化生成Fe3+,加入碳酸钠溶液的作用是中和过多的H+,调节pH,促进铁离子水解沉淀完全,再加入NH4F的目的是除去钙离子、镁离子,使最后加草酸时生成草酸镍沉淀;
故答案为:调节pH,促进铁离子水解沉淀完全;除去Ca2+、Mg2+;
(3)草酸镍(NiC2O4?2H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2)生成Ni2O3、CO、CO2,再利用化合价升降相等,Ni:升高2×(3-2),C:升高1×(4-3),C:降低:3×(3-2),配平方程式为:2NiC2O4
Ni2O3+3CO↑+CO2↑;
故答案为:2NiC2O4
Ni2O3+3CO↑+CO2↑;
(4)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确,得到离子方程式为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;
ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O
1 2
n(ClO-) a mol
则n(ClO-)=0.5 a mol
Cl2+2OH-═ClO-+Cl-+H2O
0.8n(Cl2) 0.5 a mol
则n(Cl2)=0.625 a mol
进行电解时:2Cl--2e-═Cl2↑
2 1
n(e-) 0.625 a mol
则n(e-)=1.25a mol;
故答案:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;1.25a mol;
(5)0.2 mol水的质量为3.6g,则m(Ni2O3)=20.2 g-3.6g=16.6g,n(Ni2O3)=0.1mol,即:n(Ni2O3):n(H2O)=0.1mol:0.2 mol=1:2,再利用原子守恒写成结晶水合物的形式,“1mol该物质中含有0.5 mol结晶水”,即NiOOH?
H2O或整合成:2NiOOH?H2O.
故答案为:NiOOH?
H2O 或2NiOOH?H2O.
(2)加双氧水的目的是把Fe2+氧化生成Fe3+,加入碳酸钠溶液的作用是中和过多的H+,调节pH,促进铁离子水解沉淀完全,再加入NH4F的目的是除去钙离子、镁离子,使最后加草酸时生成草酸镍沉淀;
故答案为:调节pH,促进铁离子水解沉淀完全;除去Ca2+、Mg2+;
(3)草酸镍(NiC2O4?2H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2)生成Ni2O3、CO、CO2,再利用化合价升降相等,Ni:升高2×(3-2),C:升高1×(4-3),C:降低:3×(3-2),配平方程式为:2NiC2O4
| ||
故答案为:2NiC2O4
| ||
(4)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确,得到离子方程式为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;
ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O
1 2
n(ClO-) a mol
则n(ClO-)=0.5 a mol
Cl2+2OH-═ClO-+Cl-+H2O
0.8n(Cl2) 0.5 a mol
则n(Cl2)=0.625 a mol
进行电解时:2Cl--2e-═Cl2↑
2 1
n(e-) 0.625 a mol
则n(e-)=1.25a mol;
故答案:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;1.25a mol;
(5)0.2 mol水的质量为3.6g,则m(Ni2O3)=20.2 g-3.6g=16.6g,n(Ni2O3)=0.1mol,即:n(Ni2O3):n(H2O)=0.1mol:0.2 mol=1:2,再利用原子守恒写成结晶水合物的形式,“1mol该物质中含有0.5 mol结晶水”,即NiOOH?
| 1 |
| 2 |
故答案为:NiOOH?
| 1 |
| 2 |
点评:本题考查了流程分析推断,实验操作步骤的分析判断,化学方程式计算和电解原理分析应用,题目综合性较大,难度较大.

练习册系列答案
相关题目
某温度下,将0.2molC(S)和0.3mol H2O(g)投入2L的密闭容器中,发生反应C(S)+H2O(g)?CO+H25min达到平衡后,密度增加了0.3g/L.有关下列说法正确的是( )
| A、从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol?L-1?min-1 | ||
B、达平衡时压强变为原来的
| ||
| C、此温度下该反应的平衡常数为0.0125 | ||
| D、若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
下列叙述不正确的是( )
A、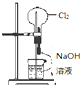 . .挤压胶头滴管后会看到烧瓶中形成喷泉 |
B、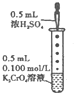 滴加几滴浓H2SO4后,溶液颜色由黄色变为橙色 |
C、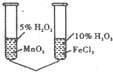 由该实验可以验证催化剂的催化效果 |
D、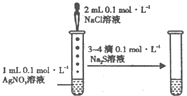 能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
下列实验操作、实验现象及解释与结论正确的是( )
| A、向某溶液中同时滴入几滴KSCN溶液和少量新制氯水 溶液变为红色 原溶液一定含有Fe2+ |
| B、向AgCl的饱和溶液中加入少量NaCl晶体 无明显现象 NaCl溶于水,阻止了AgCl的溶解 |
| C、相同温度下,测定等物质的量浓度的Na2CO3和Na2SiO3两溶液的pH 后者的pH大 碳的非金属性比硅强 |
| D、在溴水中加入少量某有机物,充分振荡、静置 溴水褪色 该有机物中含有碳碳双键 |
下列操作属于萃取的是( )
| A、向硫的二硫化碳溶液里加入水振荡 |
| B、向溴水里加汽油振荡 |
| C、向碘水里加酒精振荡 |
| D、向溴的煤油溶液里加甲苯振荡 |