题目内容
25℃时,将0.02molCH3COONa和0.01molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A: B: C:
(2)在这些粒子中,浓度为0.02mol/L的是 ;浓度为0.01mol/L的是 .
(3) 和 两种粒子物质的量之和等于0.02mol.
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A:
(2)在这些粒子中,浓度为0.02mol/L的是
(3)
考点:离子浓度大小的比较,盐类水解的原理
专题:
分析:(1)存在水的电离平衡、醋酸的电离平衡、醋酸根离子的水解平衡;
(2)根据质量守恒定律分析;
(3)根据物料守恒分析物质的量之和等于0.02mol的粒子.
(2)根据质量守恒定律分析;
(3)根据物料守恒分析物质的量之和等于0.02mol的粒子.
解答:
解:(1)存在水的电离平衡、醋酸的电离平衡、醋酸根离子的水解平衡,分别为:H2O?H++OH-、CH3COOH?CH3COO-+H+、CH3COO-+H2O?CH3COOH+OH-,
故答案为:H2O?H++OH-;CH3COOH?CH3COO-+H+;CH3COO-+H2O?CH3COOH+OH-;
(2)溶液中含有0.02mol CH3COONa,则钠离子浓度为0.02mol?L-1;含有0.01mol HCl,则氯离子的浓度为0.01mol?L-1,故答案为:Na+;Cl-;
(3)溶液中含有0.02mol CH3COONa,根据物料守恒可得:CH3COOH、CH3COO-微粒之和为0.02mol,故答案为:CH3COOH;CH3COO-.
故答案为:H2O?H++OH-;CH3COOH?CH3COO-+H+;CH3COO-+H2O?CH3COOH+OH-;
(2)溶液中含有0.02mol CH3COONa,则钠离子浓度为0.02mol?L-1;含有0.01mol HCl,则氯离子的浓度为0.01mol?L-1,故答案为:Na+;Cl-;
(3)溶液中含有0.02mol CH3COONa,根据物料守恒可得:CH3COOH、CH3COO-微粒之和为0.02mol,故答案为:CH3COOH;CH3COO-.
点评:本题考查离子反应及溶液中弱电解质的电离、盐的水解等知识,题目难度中等,把握水解原理和物料守恒、质量守恒为解答关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
化学与生活、社会密切相关.下列说法正确的是( )
| A、汽油、柴油和植物油都是碳氢化合物 |
| B、只能由粮食发酵制备乙醇 |
| C、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| D、我国规定商家不得无偿提供塑料袋,目的是减少“白色污染” |
下列关于糖类、脂肪和蛋白质的叙述正确的是( )
| A、植物油不能使溴的四氯化碳溶液褪色 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、葡萄糖能发生氧化反应和水解反应 |
| D、蛋白质溶液遇CuSO4后产生的沉淀能重新溶解 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、I- NO3- SiO32- H+ |
| B、K+ Fe3+ Cl- SO42- SCN- |
| C、K+ AlO2- SO42- NO3- |
| D、NH4+ OH- Cl- HCO3- |
甲苯能够使酸性KMnO4溶液褪色是因为( )
| A、烷烃能使酸性KMnO4溶液褪色 |
| B、苯环能使KMnO4酸性溶液褪色 |
| C、苯环使甲基的活性增强而导致的 |
| D、甲基使苯环的活性增强而导致的 |
如图是某有机物的球棍模型,下列关于该有机物的性质叙述中错误的是( )
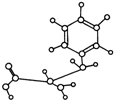

| A、能与NaOH发生反应,但不能与盐酸反应 |
| B、能合成高分子化合物 |
| C、能发生加成反应 |
| D、能发生水解反应 |
能用离子方程式“H++OH-═H2O”表示的化学反应是( )
| A、Ba(OH)2+H2SO4═BaSO4+2 H2O |
| B、2NaOH+CO2═Na2CO3+H2O |
| C、HCl+NaOH═NaCl+H2O |
| D、2HCl+Na2CO3═2NaCl+H2O+CO2↑ |
可逆反应A(g)+2B(g)?2C(g)的v-t图象如图1,若其他条件都不变,只是在反应前加入合适的催化剂,则其V-t图象如图2.①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大,以上说法正确的是( )

| A、①④⑥⑧ | B、①③⑥⑦ |
| C、②③⑤⑧ | D、②④⑤⑦ |
下列说法正确的是( )
| A、强电解质溶液的导电能力一定强于弱电解质溶液 |
| B、乙酸溶液中存在的微粒有CH3COOH、CH3COO-、H+、OH-、H2O |
| C、0.05mol的NaOH固体分别加入到体积都是100ml的自来水、0.5mol/L的乙酸、0.5mol/L的盐酸和0.5mol/L的NaCl溶液中,溶液导电能力变化最小的是自来水 |
| D、在相同温度下,a强电解质,b弱电解质,c金属Al的导电能力相同,升高温度后它们的导电能力都增强 |