题目内容
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、25℃,1.01×105Pa,64g SO2中含有的分子数为2NA | ||
| B、常温常压下,11.2L Cl2含有的分子数为0.5NA | ||
| C、标准状况下,11.2L N2和CO的混合气体的质量为28g | ||
D、1mol N
|
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、排除干扰条件,根据二氧化硫的质量计算出物质的量及含有的分子数;
B、根据是否是标准状况下进行判断;
C、根据氮气和一氧化碳的摩尔质量都是28g/mol计算出混合气体的质量;
D、根据1mol铵离子含有10mol电子进行计算.
B、根据是否是标准状况下进行判断;
C、根据氮气和一氧化碳的摩尔质量都是28g/mol计算出混合气体的质量;
D、根据1mol铵离子含有10mol电子进行计算.
解答:
解:A、64g二氧化硫的物质的量为1mol,含有的分子数为NA,故A错误;
B、不是标准状况下,无法计算11.2L氯气的物质的量,故B错误;
C、标准状况下,11.2L氮气和一氧化碳的物质的量为0.5mol,氮气和一氧化碳的摩尔质量都是28g/mol,所以质量为14g,故C错误;
D、1mol铵离子中含有10mol电子,含有的电子数为10NA,故D正确;
故选:D.
B、不是标准状况下,无法计算11.2L氯气的物质的量,故B错误;
C、标准状况下,11.2L氮气和一氧化碳的物质的量为0.5mol,氮气和一氧化碳的摩尔质量都是28g/mol,所以质量为14g,故C错误;
D、1mol铵离子中含有10mol电子,含有的电子数为10NA,故D正确;
故选:D.
点评:本题考查了阿伏伽德罗常数,注意标准状况下的条件及物质的状态,注意1mol铵离子含有10mol电子,本题难度不大.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
下列各组离子在所给条件下能够大量共存的是( )
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、水电离出的c(H+)=1×10-13mol/L的溶液中:K+、HCO3-、Cl-、S2- |
| C、使紫色石蕊试液显蓝色的溶液中:Mg2+、NO3-、Fe3+、SO42- |
| D、溶有碳酸氢钠的溶液:K+、SO42-、Cl-、OH- |
下列对化学知识概括合理的一组是( )
①能与酸反应的氧化物,一定是碱性氧化物
②一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
③根据是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
④根据分散系是否有丁达尔现象将分散系分为溶液、胶体和浊液
⑤在熔化状态和水溶液中均不能导电的物质称为非电解质
⑥氧化剂在反应中被氧化,还原剂在反应中被还原.
①能与酸反应的氧化物,一定是碱性氧化物
②一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
③根据是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
④根据分散系是否有丁达尔现象将分散系分为溶液、胶体和浊液
⑤在熔化状态和水溶液中均不能导电的物质称为非电解质
⑥氧化剂在反应中被氧化,还原剂在反应中被还原.
| A、只有①②③ | B、只有②③⑤ |
| C、只有③ | D、只有②④⑥ |
在配制一定物质的量浓度的溶液的实验中,下列操作正确的是( )
| A、将氢氧化钠固体放在天平托盘的滤纸上,精确称量并放入烧杯中溶解后,立即注入容量瓶中 |
| B、将准确量取的18.4mol?L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
| C、仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液 |
| D、欲配制1000mL 0.1mol?L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线 |
标况下由0.5g H2、11g CO和4g O2组成的混合气体,其体积约为( )
| A、8.4 L |
| B、11.2 L |
| C、14.0 L |
| D、16.8 L |
 如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )
如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )| A、该反应的化学方程式可表达为2M+N?2P |
| B、在反应时间为20min-25min之内,物质M的反应速率为0.002mol/(L?min) |
| C、当反应时间为20min时,曲线开始发生变化的原理可能是由于增大压强引起的 |
| D、反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的(其它条件不变),则该反应的正反应一定为吸热反应 |
下列物质的变质过程中,既有氧化还原反应,又有非氧化还原反应的是( )
| A、Ca(ClO)2 |
| B、NaOH |
| C、FeSO4 |
| D、Na2SO3 |
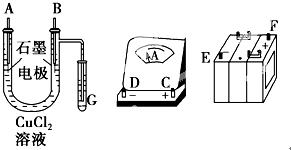 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为: