题目内容
15.已知20g NaOH与100mL稀盐酸恰好完全反应,请回答:(1)写出NaOH与盐酸反应的化学方程式:NaOH+HCl=NaCl+H2O.
(2)20gNaOH的物质的量是多少?
(3)稀盐酸中HCl的物质的量浓度是多少?
分析 (1)氢氧化钠与盐酸发生中和反应反应生成NaCl与水;
(2)根据n=$\frac{m}{M}$计算NaOH的物质的量;
(3)NaOH与HCl的物质的量相等,结合c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)氢氧化钠与盐酸发生中和反应反应生成NaCl与水,反应方程式为:NaOH+HCl=NaCl+H2O,
故答案为:NaOH+HCl=NaCl+H2O;
(2)NaOH的摩尔质量为40g/mol,20g NaOH的物质的量为$\frac{20g}{40g/mol}$=0.4mol,
答:20g NaOH的物质的量为0.4mol;
(3)由NaOH+HCl=NaCl+H2O,可知n(HCl)=n(NaOH)=0.2mol,盐酸的物质的量浓度为$\frac{0.2mol}{0.1L}$=2mol/L,
答:该盐酸的物质的量浓度为2mol/L.
点评 本题考查物质的量有关计算、化学方程式计算,比较基础,旨在考查学生对基础知识的巩固,掌握以物质的量为中心的有关计算.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
5.下列说法正确的是( )
| A. | 淀粉和纤维素都可以用(C6H10O5)n表示,所以二者属于同分异构体 | |
| B. | 蛋白质溶液中加入重金属盐而凝聚,但蛋白质不会失去生理活性 | |
| C. | 油脂的皂化反应是在碱性条件下发生水解反应 | |
| D. | 所有有机物中都含有官能团 |
6.在铁和氧化铁混合物15g中,加入稀硫酸150mL,能放出H2 1.68L(标准状况).同时铁和氧化铁均无剩余,向反应后的溶液中滴入KSCN溶液,未见颜色变化.为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共消耗3mol•L-1的NaOH溶液200mL,则原硫酸的物质的量浓度是( )
| A. | 1.5 mol•L-1 | B. | 2 mol•L-1 | C. | 2.5 mol•L-1 | D. | 3 mol•L-1 |
3.以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热
②用排水法收集汽体时,先移出导管后撤酒精灯
③制取物质时,先检查装置气密性后装药品
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净
⑤做H2还原CuO实验时,先通H2流后加热CuO;反应完毕后,先撤酒精灯待试管冷却后停止通H2点燃可燃性气体(如H2、CH4、C2H2等)时,先检验气体纯度后点燃.
①加热试管时,先均匀加热,后局部加热
②用排水法收集汽体时,先移出导管后撤酒精灯
③制取物质时,先检查装置气密性后装药品
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净
⑤做H2还原CuO实验时,先通H2流后加热CuO;反应完毕后,先撤酒精灯待试管冷却后停止通H2点燃可燃性气体(如H2、CH4、C2H2等)时,先检验气体纯度后点燃.
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
10. ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:
回答下列问题:
(1)碲(Te)的氧化物分子式是TeO2、TeO3.
(2)硒酸与碲酸酸性较强的是H2SeO4(填化学式).
(3)比较键能:H-S>H-Se(填“>”或“<”).
(4)氢硒酸放在空气中,可能发生反应的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)如图所示为ⅥA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示 VIA 族中某一元素的单质,如图为相同物质的量的单质与 H2反应过程中的体系温度变化.则:c 代表硒.(均写单质名称)
 ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:| 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218.4 | 113 | 271 | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)碲(Te)的氧化物分子式是TeO2、TeO3.
(2)硒酸与碲酸酸性较强的是H2SeO4(填化学式).
(3)比较键能:H-S>H-Se(填“>”或“<”).
(4)氢硒酸放在空气中,可能发生反应的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)如图所示为ⅥA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示 VIA 族中某一元素的单质,如图为相同物质的量的单质与 H2反应过程中的体系温度变化.则:c 代表硒.(均写单质名称)
20.在2L密闭容器中进行反应:mX(g)+nY(g)?pZ(g)+qQ(g),式中m、n、p、q为化学计量数.在0~3min内,各物质物质的量的变化如表所示:
已知:2min内v(Q)=0.075mol•L-1•min-1,v(Z):v(Y)=1:2.
(1)2min内Z的反应速率v(Z)=0.05mol•L-1•min-1.
(2)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(3)方程式中m=1,n=4,p=2,q=3.
(4)对于该反应,能增大正反应速率的措施是CD
A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度
(5)该反应达到化学平衡状态时D
A.反应停止了 B.正反应速率与逆反应速率均为0
C.反应物与生成物浓度相等 D.正反应速率与逆反应速率相等.
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
(1)2min内Z的反应速率v(Z)=0.05mol•L-1•min-1.
(2)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(3)方程式中m=1,n=4,p=2,q=3.
(4)对于该反应,能增大正反应速率的措施是CD
A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度
(5)该反应达到化学平衡状态时D
A.反应停止了 B.正反应速率与逆反应速率均为0
C.反应物与生成物浓度相等 D.正反应速率与逆反应速率相等.
7.对于可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | NH3和H2O化学反应速率关系是2v正(NH3)=3v正(H2O) | |
| B. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
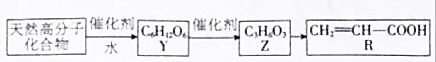
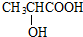
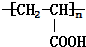
 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.