题目内容
4.(1)某学生为了探究铝与盐酸反应过程中的速率变化,他用排水集气法收集反应放出的氢气,实验记录如下:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 150 | 300 | 380 | 410 |
②哪一段时段的反应速率最小4~5 min,原因是此时H+浓度小.
(2)另一学生也做同样的实验,由于反应太快,不好控制测量氢气的体积,他事先在盐酸中加入等体积的下列溶液:A、蒸馏水 B、CuCl2溶液 C、NaNO3溶液,以减慢反应速率,你认为可行的是A,不可行的是BC,不可行的理由是加入少量CuCl2晶体时,CuCl2会与锌反应置换出铜,Al、铜与酸会形成原电池,发生原电池反应而加快反应速率;加入硝酸钠溶液时,存在的硝酸根离子和氢离子相当于存在硝酸,金属铝和硝酸反应不会产生氢气..
(3)下列各分子中,所有原子都满足最外层为8电子结构的是③④⑥⑦
①H2O ②BF3 ③CCl4 ④PCl3 ⑤SO3 ⑥N2 ⑦CO2.
分析 (1)影响化学反应速率的因素有浓度、温度以及固体的表面积大小等因素,温度越高、浓度越大、固体表面积越大,反应的速率越大,从表中数据看出2 min~3 min收集的氢气比其他时间段多,原因是Zn置换H2的反应是放热反应,温度升高;4 min~5 min收集的氢气最少是因为随反应进行c(H+)下降;
(2)影响反应速率的因素:浓度、原电池原理、温度、压强等,据此回答判断;
(3)根据原子最外层电子数和化合价判断,在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,以此进行分析.
解答 解:(1)①0~1、l~2、2~3、3~4、4~5min各时间段生成氢气的体积分别为50、150、300、380、410,可以看出反应速率最大的是2~3min,锌与稀硫酸反应为放热反应,随反应的进行,温度越来越高,反应速率加快,
故答案为:2~3min;因该反应是放热反应,此时温度高;
②4 min~5 min收集的氢气最少是因为随反应进行c(H+)下降,反应物浓度越低,反应速率越小,
故答案为:4~5 min,此时H+浓度小;
(2)为了减慢反应速率,可以降低反应温度、减低反应物的浓度,加入蒸馏水可以扩大酸溶液的体积而降低其浓度,加入硝酸钠溶液时,存在的硝酸根离子和氢离子相当于存在硝酸,金属铝和硝酸反应不会产生氢气,当加入少量CuCl2晶体时,CuCl2会与锌反应置换出铜,Al、铜与酸会形成原电池,发生原电池反应而加快反应速率,
故答案为:A;BC;加入少量CuCl2晶体时,CuCl2会与锌反应置换出铜,Al、铜与酸会形成原电池,发生原电池反应而加快反应速率;加入硝酸钠溶液时,存在的硝酸根离子和氢离子相当于存在硝酸,金属铝和硝酸反应不会产生氢气;
(3)根据原子最外层电子数和化合价判断,在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,
①H2O中的H原子不满足最外层为8电子结构,故错误;
②BF3B原不满足最外层为8电子结构,故错误;
③CCl4原子都满足最外层为8电子结构,故正确;
④PCl3原子都满足最外层为8电子结构,故正确;
⑤SO3S原子不满足最外层为8电子结构,故错误;
⑥N2满足最外层为8电子结构,故正确;
⑦CO2原子都满足最外层为8电子结构,故正确;
故答案为:③④⑥⑦.
点评 本题考查化学反应速率的影响因素,题目难度不大,注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,注重基础知识的积累.

(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
②2260℃时,向2L密闭容器中充入0.3mol N2和0.3mol O2,20s时反应达平衡.则此时得到NO0.2mol,用N2表示的平均反应速率为0.0025mol/(L•s).
(2)已知工业固氮反应:N2(g)+3H2 (g)?2NH3 (g)△H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中正确的是B(填“A”或“B”),T1>T2(填“>”或“<”).

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,通过电解实现高温常压下的电化学合成氨.其示意图如C所示,阴极的电极反应式为N2+6e-+6H+=2NH3
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:
2N2 (g)+6H2 0(l)?4NH3(aq)+302(g)△H
已知:N2 (g)+3H2(g)?2NH3 (g)△H1
2H2(g)+02 (g)?2H2 0(1)△H2
NH3 (g)?NH3(aq)△H3
则△H=2△H1-3△H2+4△H3(用含△H1、△H2、△H3的式子表示).
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
| A. | NaH在水中显碱性 | |
| B. | NaH中氢离子电子层排布与氦原子相同 | |
| C. | NaH中氢离子半径比锂离子半径大 | |
| D. | NaH中氢离子被还原为H2 |
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大的主要原因是减小了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大活化分子的百分数,从而成千上万倍地增大反应速率 |
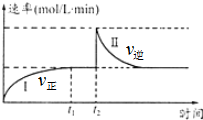 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(| A. | 0~t2时,v正>v逆 | |
| B. | t2时刻改变的条件可能是加催化剂 | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
| A. | X、Y、Z、W 元素的离子半径依次减小 | |
| B. | W 的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| C. | 若W 与Y的原子序数相差5,则二者形成的化合物的化学式可能为Y2W3或Y3W2 | |
| D. | W 与X形成的化合物只含离子键 |
| A. | R原子最外层电子数为5 | B. | 单质的氧化性:甲<乙 | ||
| C. | 原子半径:R>Z | D. | HRO3与HZ计量数之比为1:5 |
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z) | |
| B. | 气态氢化物的热稳定性:X>Y | |
| C. | 元素X的最高价氧化物对应的水化物是强酸 | |
| D. | 化合物XY、Z2Y、Z2Y2中化学键的类型相同 |