题目内容
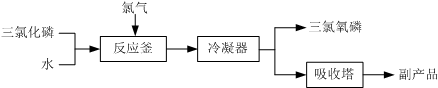
溴化钙是一种溴化物,用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等.制备CaBr2?2H2O的主要流程如下:

(1)与液溴的反应温度不能超过40℃的原因是 .
(2)滤渣的成分可能是 .
(3)试剂M是 ,加入M的目的是 .
(4)操作Ⅱ的步骤为蒸发浓缩, 、洗涤、干燥.
(5)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式 .
(6)制得的CaBr2?2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,得到2.00g固体.则CaBr2?2H2O的质量分数为 .(相对原子质量:Ca-40 Br-80 H-1 O-16)

(1)与液溴的反应温度不能超过40℃的原因是
(2)滤渣的成分可能是
(3)试剂M是
(4)操作Ⅱ的步骤为蒸发浓缩,
(5)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式
(6)制得的CaBr2?2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,得到2.00g固体.则CaBr2?2H2O的质量分数为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:Fe与溴单质反应生成FeBr2 ,加过量的氢氧化钙,生成氢氧化亚铁沉淀,氢氧化亚铁易被氧气氧化为氢氧化铁,过滤得到滤液中主要CaBr2 ,在滤液中加HBr中和多余的氢氧化钙,然后蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到CaBr2?2H2O晶体;
(1)溴单质受热易挥发;
(2)滤渣中除了是的氢氧化亚铁,还有剩余的Fe,和氧化生成的氢氧化铁;
(3)加入的氢氧化钙过量,加溴化氢除去;
(4)根据从溶液中提取固体溶质的操作分析;
(5)氨气通入石灰乳,加入溴,在65℃反应生成溴化钙、氮气和水;
(6)根据CaBr2?2H2O~Na2CO3~CaCO3,由碳酸钙的质量求出CaBr2?2H2O,再求出质量分数.
(1)溴单质受热易挥发;
(2)滤渣中除了是的氢氧化亚铁,还有剩余的Fe,和氧化生成的氢氧化铁;
(3)加入的氢氧化钙过量,加溴化氢除去;
(4)根据从溶液中提取固体溶质的操作分析;
(5)氨气通入石灰乳,加入溴,在65℃反应生成溴化钙、氮气和水;
(6)根据CaBr2?2H2O~Na2CO3~CaCO3,由碳酸钙的质量求出CaBr2?2H2O,再求出质量分数.
解答:
解:Fe与溴单质反应生成FeBr2 ,加过量的氢氧化钙,生成氢氧化亚铁沉淀,氢氧化亚铁易被氧气氧化为氢氧化铁,过滤得到滤液中主要CaBr2 ,在滤液中加HBr中和多余的氢氧化钙,然后蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到CaBr2?2H2O晶体;
(1)溴单质受热易挥发,所以控制反应在较低温度不能超过40℃进行,防止液溴挥发,降低原料利用率,
故答案为:防止液溴挥发,降低原料利用率;
(2)滤渣中除了是的氢氧化亚铁,还有剩余的Fe,和氧化生成的氢氧化铁,所以滤渣的成分可能是Fe、Fe(OH)2 、Fe(OH)3,
故答案为:Fe、Fe(OH)2 、Fe(OH)3;
(3)溴化亚铁溶液中加入过量的氢氧化钙,过梁得到的滤液含有溴化钙和氢氧化钙,加溴化氢除去多余的氢氧化钙,则加入的M为HBr,
故答案为:HBr;除去过量的Ca(OH)2;
(4)从溶液中提取固体溶质的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶、过滤;
(5)氨气通入石灰乳,加入溴,在65℃反应生成溴化钙、氮气和水,其反应的化学方程式为3Ca(OH)2 +3Br2+2NH3
3CaBr2+N2↑+6H2O,
故答案为:3Ca(OH)2 +3Br2+2NH3
3CaBr2+N2↑+6H2O;
(6)称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,得到2.00g固体,则生成的固体为碳酸钙,
设样品中CaBr2?2H2O的质量为xg,
CaBr2?2H2O~Na2CO3~CaCO3,
236 100
xg 2.00g
则x=
=4.72g,
则CaBr2?2H2O的质量分数为
×100%=94.40%,
故答案为:94.40%.
(1)溴单质受热易挥发,所以控制反应在较低温度不能超过40℃进行,防止液溴挥发,降低原料利用率,
故答案为:防止液溴挥发,降低原料利用率;
(2)滤渣中除了是的氢氧化亚铁,还有剩余的Fe,和氧化生成的氢氧化铁,所以滤渣的成分可能是Fe、Fe(OH)2 、Fe(OH)3,
故答案为:Fe、Fe(OH)2 、Fe(OH)3;
(3)溴化亚铁溶液中加入过量的氢氧化钙,过梁得到的滤液含有溴化钙和氢氧化钙,加溴化氢除去多余的氢氧化钙,则加入的M为HBr,
故答案为:HBr;除去过量的Ca(OH)2;
(4)从溶液中提取固体溶质的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶、过滤;
(5)氨气通入石灰乳,加入溴,在65℃反应生成溴化钙、氮气和水,其反应的化学方程式为3Ca(OH)2 +3Br2+2NH3
| ||
故答案为:3Ca(OH)2 +3Br2+2NH3
| ||
(6)称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,得到2.00g固体,则生成的固体为碳酸钙,
设样品中CaBr2?2H2O的质量为xg,
CaBr2?2H2O~Na2CO3~CaCO3,
236 100
xg 2.00g
则x=
| 236×2.00g |
| 100 |
则CaBr2?2H2O的质量分数为
| 4.72g |
| 5.00g |
故答案为:94.40%.
点评:本题考查了溴化钙晶体的制备实验方案设计,题目涉及化学实验基本操作、除杂质、离子方程式的书写、含量的计算等,题目难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与分析问题、解决问题的能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
化学反应伴随能量变化,下列说法中错误的是( )
| A、TNT(炸药)爆炸时部分化学能转化为热能 |
| B、电解饱和食盐水时部分化学能转化为电能 |
| C、镁条燃烧时部分化学能转化为光能 |
| D、植物光合作用时部分光能转化为化学能 |
常温下,将pH=12的烧碱和pH=2乙酸溶液等体积混合,充分反应后溶液的pH ( )
| A、pH<7 | B、pH>7 |
| C、pH=7 | D、无法判断 |