题目内容
【题目】在下图装置中,加热试管内的白色固体A(A的焰色反应为黄色),生成白色固体B并放出气体C和D,这些气体通过甲瓶的浓硫酸后,C被吸收;D进入乙瓶跟另一淡黄色固体E反应生成白色固体B和气体F;丙瓶中的NaOH溶液用来吸收剩余的气体D。
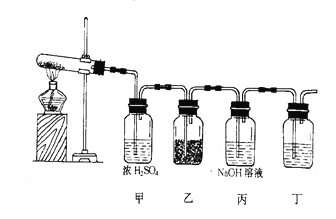
(1)写出各物质的化学式:
A______; B_______; C________; D______; E_______; F___________。
(2)写出试管中及丙瓶中反应的化学方程式:_______________;__________________。
(3)等物质的量A、B分别与足量的盐酸反应生成气体的体积________(填“一样多”、“前者多”、“后者多”)。
【答案】 NaHCO3 Na2CO3 H2O CO2 Na2O2 O2 2NaHCO3![]() Na2CO3+H2O+CO2↑ CO2+2NaOH==Na2CO3+H2O 一样多
Na2CO3+H2O+CO2↑ CO2+2NaOH==Na2CO3+H2O 一样多
【解析】加热白色固体A(A灼烧时火焰为黄色)生成白色固体B,并放出气体C和D,则A、B含有Na元素,气体D与淡黄色固体E反应,生成固体B和气体F,应是Na2O2与CO2反应生成Na2CO3与O2,可推知D为CO2,E为Na2O2,B为Na2CO3,F为O2,故A为NaHCO3,C为水蒸气。
(1)根据以上分析可知A是NaHCO3,B是Na2CO3,C是H2O,D是CO2,E是Na2O2,F是O2。(2)根据以上分析可知试管中及丙瓶中反应的化学方程式分别为2NaHCO3![]() Na2CO3+H2O+CO2↑、CO2+2NaOH==Na2CO3+H2O。(3)等物质的量A、B中碳原子的物质的量相等,则分别与足量的盐酸反应生成气体的体积一样多。
Na2CO3+H2O+CO2↑、CO2+2NaOH==Na2CO3+H2O。(3)等物质的量A、B中碳原子的物质的量相等,则分别与足量的盐酸反应生成气体的体积一样多。

【题目】含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.
(1)氨是一种重要化工原料.合成氨原料气H2 , 可用天然气为原料制得,有关反应能量变化如图1所示.则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物.(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如下表:
时间/S | 0 | 20 | 40 | 60 | 80 |
N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在150℃达到平衡时,该反应平衡常数K= . (填数值)
②若最初通入N2O4 , 在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为 .
(ii)氨氧化制HNO3的尾气中含有NO和NO2 , 且n(NO):n(NO2)=1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污
染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)图2表示合成塔中氨碳比a与CO2转化率ω的关系.a为[n(NH3):n(CO2)],b为水碳比[n(H2O):n(CO2)].则:
①b应控制在;
A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 .
