题目内容
已知一个脂类分子的相对分子质量为391,一分子该物质燃烧可生成10分子H2O和18分子CO2,已知N(N:14)的含量为7%,P(P:31)的含量为8%,求该物质的分子式 .
考点:有关有机物分子式确定的计算
专题:有机化学基础
分析:一分子该物质燃烧可生成10分子H2O和18分子CO2,可知分子中含有18个C原子、20个H原子,已知N(N:14)的含量为7%,P(P:31)的含量为8%,结合相对分子质量可确定有机物中含有N、P的个数,进而确定O原子的个数,可确定有机物分子式.
解答:
解:一分子该物质燃烧可生成10分子H2O和18分子CO2,可知分子中含有18个C原子、20个H原子,
已知N(N:14)的含量为7%,P(P:31)的含量为8%,
则N原子个数为
=2,
P原子个数为
=1,
则含有O原子的个数为
=6,
则有机物的分子式为C18H20O6N2P,
故答案为:C18H20O6N2P.
已知N(N:14)的含量为7%,P(P:31)的含量为8%,
则N原子个数为
| 391×7% |
| 14 |
P原子个数为
| 391×8% |
| 31 |
则含有O原子的个数为
| 391-18×12-20-2×14-1×31 |
| 16 |
则有机物的分子式为C18H20O6N2P,
故答案为:C18H20O6N2P.
点评:本题考查有机物分子式的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握计算的思路,难度不大.

练习册系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O=Na++2OH-?+H2↑ |
| B、氯气通入溴化钾溶液:Cl2+2Br=Br2+2Cl- |
| C、铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2? |
| D、稀硫酸和氢氧化铜反应:H++OH-=H2O |
下列说法正确的是( )
| A、摩尔质量就等于物质的相对分子质量 |
| B、摩尔质量就是物质相对分子质量的6.02×1023倍 |
| C、HNO3的摩尔质量是63 g |
| D、硫酸和磷酸的摩尔质量相等 |
要除去苯中的苯酚杂质,通常采用的方法是( )
| A、加水振荡后用分液漏斗分离 |
| B、加稀盐酸振荡后用分液漏斗分离 |
| C、加氢氧化钠溶后用分液漏斗分离 |
| D、加溴水振荡后滤去白色沉淀 |
下列叙述正确的是( )
| A、氯化钠是电解质,所以氯化钠固体能导电 |
| B、二氧化碳溶于水得到的溶液能导电,所以二氧化碳是电解质 |
| C、铜能导电,所以铜是电解质 |
| D、碳酸钙难溶于水,但为强电解质 |
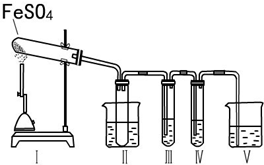 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.