题目内容
根据下表中烃的分子式排列规律,空格中烃的同分异构体中一氯代物种数不可能是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A、1种 | B、2种 | C、3种 | D、4种 |
考点:同分异构现象和同分异构体
专题:同分异构体的类型及其判定
分析:根据表格中物质的化学式的规律,可知5号物质为C5H12.再根据碳链异构体判断同分异构体,最后通过氢原子的种类等于一氯代物种数来判断;
解答:
解:C5H12有正戊烷、异戊烷、新戊烷3种同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)CH3、C(CH3)4,
CH3CH2CH2CH2CH3分子中含有3种氢原子,一氯代物种数是3;
CH3CH2CH(CH3)CH3分子中含有4种氢原子,一氯代物种数是4;
C(CH3)4分子中含有1种氢原子,一氯代物种数是1;
故选B.
CH3CH2CH2CH2CH3分子中含有3种氢原子,一氯代物种数是3;
CH3CH2CH(CH3)CH3分子中含有4种氢原子,一氯代物种数是4;
C(CH3)4分子中含有1种氢原子,一氯代物种数是1;
故选B.
点评:本题考查同分异构体的书写、归纳与整理的能力,难度不大,注意对比化学式发现物质组成所存在的规律是关键,易错点是等效氢的判断.

练习册系列答案
相关题目
在一定温度下,反应H2(g)+X2(g)?2HX(g)的平衡常数为4.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
| A、17% | B、25% |
| C、33% | D、50% |
下列图象描述正确的是( )
A、 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 |
B、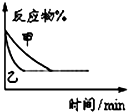 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |
C、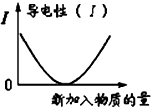 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D、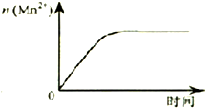 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
下列物质的电离方程式,不正确的是( )
| A、NaClO=Na++ClO- |
| B、H2CO3?2H++CO32- |
| C、NaHSO4═H++SO42-+Na+ |
| D、Al2(SO4)3=2Al3++3SO42- |
下列事实不能证明亚硝酸是弱电解质的是( )
| A、NaNO2在水溶液中完全电离 |
| B、HNO2能使石蕊试液变红 |
| C、等物质的量浓度的HNO2的导电能力比盐酸弱 |
| D、0.1mol/L的HNO2溶液的PH为2 |
下列离子方程式正确的是( )
| A、氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| B、向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-=Fe3++NO↑+2H2O |
| D、向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O |
已知0.1mol?L-1的NaHSO4溶液中,c(H+)=0.1mol?L-1,则NaHSO4在水溶液中的电离方程式是( )
| A、NaHSO4=Na++HSO4- |
| B、NaHSO4=Na++H++SO42- |
| C、NaHSO4=Na++H++S6++4O2- |
| D、NaHSO4=NaH2++SO42- |
用铂作电极电解1L含有0.4molCuSO4和0.2molNaCl的水溶液,一段时间后在一个电极上得到了19.2g Cu,在另一极上析出的气体在标况下的体积是( )
| A、4.48L |
| B、5.6L |
| C、6.72L |
| D、13.44L |