题目内容
某化学科研小组研究在其他条件不变时,改变某一条件对反应(可用aA(g)+bB(g)?cC(g)表示)的化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,?表示体积分数).根据图象,下列判断正确的是( )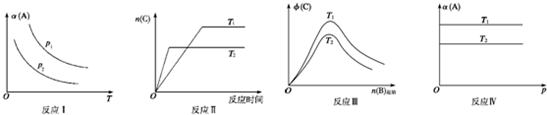

| A、反应Ⅰ:若p1>p2,则此反应只能在高温下自发进行 |
| B、反应Ⅱ:此反应的△H<0,且T1<T2 |
| C、反应III:△H>0且T2>T1或△H<0且T2<T1 |
| D、反应Ⅳ:T1<T2,则该反应不易自发进行 |
考点:化学平衡建立的过程
专题:图示题
分析:A、由反应1图可知,增大压强,A的转化率增大,平衡正向移动,说明正反应是熵减的反应,升温平衡正向移动,说明正反应是放热反应,据此判断;
B、由图可知,T2的起始斜率大于T1,说明T1<T2,升高温度,C的物质的量减小,平衡逆向移动,说明正反应是放热反应,据此判断;
C、根据温度对平衡移动的影响判断;
D、温度越高,反应物的转化率越低,说明该反应为放热反应,据此判断.
B、由图可知,T2的起始斜率大于T1,说明T1<T2,升高温度,C的物质的量减小,平衡逆向移动,说明正反应是放热反应,据此判断;
C、根据温度对平衡移动的影响判断;
D、温度越高,反应物的转化率越低,说明该反应为放热反应,据此判断.
解答:
解:A、由反应1图可知,增大压强,A的转化率增大,平衡正向移动,说明正反应是熵减的反应,升温平衡正向移动,说明正反应是放热反应,根据△G=△H-T△S可知,该反应在低温度时更容易自发进行,故A错误;
B、由图可知,T2的起始斜率大于T1,说明T1<T2,升高温度,C的物质的量减小,平衡逆向移动,说明正反应是放热反应,故B正确;
C、如果反应III中△H>0,要使生成物C的体积分数增大,则应当是T2<T1,故C错误;
D、温度越高,反应物的转化率越低,说明该反应为放热反应,△H<0,该反应容易自发,故D错误;
故选B.
B、由图可知,T2的起始斜率大于T1,说明T1<T2,升高温度,C的物质的量减小,平衡逆向移动,说明正反应是放热反应,故B正确;
C、如果反应III中△H>0,要使生成物C的体积分数增大,则应当是T2<T1,故C错误;
D、温度越高,反应物的转化率越低,说明该反应为放热反应,△H<0,该反应容易自发,故D错误;
故选B.
点评:本题主要考查了根据图象判断反应的特征,中等难度,解题时要注意观察图以及基础本原理的应用.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、氯化镁固体之所以不导电的原因是氯化镁固体中不含阴、阳离子 |
| B、在电流作用下氯化钠在水溶液中电离成钠离子和氯离子 |
| C、氯化钾固体不能导电而其水溶液能导电的原因是氯化钾与水发生反应产生了钾离子和氯离子 |
| D、氯化钾固体不能导电的原因是构成氯化钾固体的钾离子和氯离子不能自由移动,而溶于水后在水分子的作用下产生自由移动的钾离子和氯离子,所以其水溶液能导电 |
采用循环操作可以提高原料的利用率,下列工业生产中,没有采用循环操作的是( )
| A、硫酸工业 | B、氯碱工业 |
| C、硝酸工业 | D、合成氨工业 |
100mL 6mol?L-1H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A、碳酸钠(s) |
| B、硫酸钠(s) |
| C、醋酸钠(s) |
| D、硫酸铵(s) |
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O Cl2→Cl-MnO4-→Mn2+ HNO3→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
| A、H2O2 |
| B、Cl2 |
| C、MnO4- |
| D、HNO3 |
下列说法或表示法正确的是( )
| A、等量的硫蒸汽和硫固体分别完全燃烧,后者放出热量多 |
| B、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l);△H=-285.8kJ/mol |
| C、在稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ/mol,则稀醋酸溶液与稀氢氧化钠溶液混合,中和热仍为57.3kJ/mol |
| D、由C(石墨)→C(金刚石):△H=+119kJ/mol可知,石墨比金刚石稳定 |
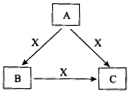 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.若A、B、C的焰色反应均呈黄色,水溶液均为碱性.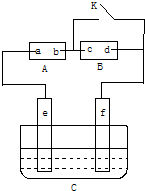 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空: