题目内容
100mL 6mol?L-1H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A、碳酸钠(s) |
| B、硫酸钠(s) |
| C、醋酸钠(s) |
| D、硫酸铵(s) |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答:
解:A.加适量的碳酸钠,会与酸反应,生成氢气的量减少,故A错误;
B.加适量的Na2SO4(s),对反应速率无影响,故B错误;
C.加适量的醋酸钠,会和硫酸反应生成醋酸,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故C正确;
D.加适量的(NH4)2SO4(s),Zn与铵根离子水解生成的氢离子反应生成氢气,反应速率加快,氢气的量增大,故D错误;
故选C.
B.加适量的Na2SO4(s),对反应速率无影响,故B错误;
C.加适量的醋酸钠,会和硫酸反应生成醋酸,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故C正确;
D.加适量的(NH4)2SO4(s),Zn与铵根离子水解生成的氢离子反应生成氢气,反应速率加快,氢气的量增大,故D错误;
故选C.
点评:本题考查影响化学反应速率的因素,明确浓度对反应速率的影响即可解答,选项D为学生解答中的难点,注意D中水解生成氢离子,题目难度不大.

练习册系列答案
相关题目
与 互为同分异构体的是( )
互为同分异构体的是( )
 互为同分异构体的是( )
互为同分异构体的是( )A、 |
B、 |
C、 |
D、 |
下列说法正确的是( )
| A、弱电解质的电离过程是吸热过程 |
| B、升高温度可以抑制盐类的水解 |
| C、正盐水溶液pH均为7 |
| D、硫酸钠水溶液pH小于7 |
 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容刚性密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).则Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容刚性密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).则Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )| A、若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ<Ⅱ |
| B、若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| C、若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同 |
| D、平衡时Ⅰ容器的体积小于V L |
某化学科研小组研究在其他条件不变时,改变某一条件对反应(可用aA(g)+bB(g)?cC(g)表示)的化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,?表示体积分数).根据图象,下列判断正确的是( )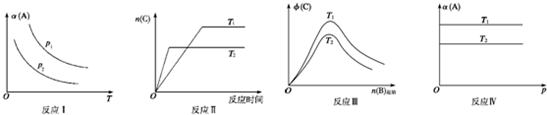

| A、反应Ⅰ:若p1>p2,则此反应只能在高温下自发进行 |
| B、反应Ⅱ:此反应的△H<0,且T1<T2 |
| C、反应III:△H>0且T2>T1或△H<0且T2<T1 |
| D、反应Ⅳ:T1<T2,则该反应不易自发进行 |
下列关于金属腐蚀的说法中不正确的是( )
| A、金属腐蚀的本质是金属原子失去电子而被氧化 |
| B、金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C、纯的金属一般难以发生电化学腐蚀 |
| D、镀锌铁当镀层破损后,镀层则对铁失去了保护作用 |