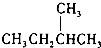题目内容
15.锌和硫酸反应的速率与时间的关系如图所示,则:
(1)写出锌和硫酸反应的离子方程式Zn+2H+=Zn2++H2↑,该反应中氧化剂是硫酸.
(2)反应开始时,速率加快的原因为温度升高,反应速率加.
(3)后期反应速率下降的原因为反应物浓度减小.
分析 锌和稀硫酸反应生成硫酸锌和氢气,由图可知,反应速率先增大,后减小,开始与氢离子浓度有关,后来与反应物浓度有关,以此来解答.
解答 解:(1)锌和稀硫酸反应生成硫酸锌和氢气,离子方程式为Zn+2H+=Zn2++H2↑,硫酸为氧化剂,故答案为:Zn+2H+=Zn2++H2↑;硫酸;
(2)反应开始时反应速率加快的原因是温度升高,反应速率加快,故答案为:温度升高,反应速率加快;
(3)反应后期反应速率下降,是因随着反应的进行,反应物的浓度减少,反应速率减小,故答案为:反应物浓度减小.
点评 本题考查化学反应速率的影响因素,为高频考点,把握习题中的信息及浓度对反应速率的影响为解答的关键,侧重分析能力及知识应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.八硝基立方烷是一种烈性炸药,请问立方烷的六硝基取代物有几种同分异构体( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
6.氯的原子序数为17,37Cl和35Cl是氯的两种同位素,下列说法正确的是( )
| A. | 35Cl原子所含质子数为18,37Cl和35Cl得电子能力相同 | |
| B. | $\frac{1}{18}$mol的H35Cl分子所含中子数约为6.02×1023 | |
| C. | 7 g的35Cl2气体的体积为2.24 L | |
| D. | 35Cl的相对原子质量是12C原子质量的35倍 |
3.对有机物: 的下列说法中不正确的是( )
的下列说法中不正确的是( )
 的下列说法中不正确的是( )
的下列说法中不正确的是( )| A. | 常温下能与NaHCO3溶液反应放出CO2 | |
| B. | 在碱性条件下能发生水解反应,1摩该有机物完全反应消耗掉8摩NaOH | |
| C. | 与稀H2SO4共热,生成2种有机物 | |
| D. | 该有机物的分子式为C14H10O9 |
10.硅元素在周期表中的位置是( )
| A. | 第二周期IVA族 | B. | 第三周期IVA族 | C. | 第三周期VIA族 | D. | 第二周期VIA族 |
20.居里夫人发现的镭是元素周期表中第七周期第ⅡA族的元素,下列关于镭的性质描述不正确的是( )
| A. | 在化合物中呈+2价 | B. | 单质能与水反应,放出氢气 | ||
| C. | 氢氧化物呈两性 | D. | 碳酸盐难溶于水 |
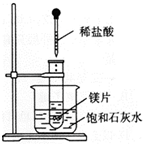 在一只试管中放入几小块镁片,把试管放入盛有25℃的饱和石灰水的烧杯中,用胶头滴管滴5mL盐酸于试管中.试回答下列问题:
在一只试管中放入几小块镁片,把试管放入盛有25℃的饱和石灰水的烧杯中,用胶头滴管滴5mL盐酸于试管中.试回答下列问题: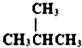 和
和 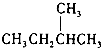 ⑧
⑧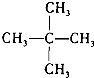 和
和