题目内容
5.运用所学化学原理,解决下列问题:(1)已知:Si+2NaOH+H2O═Na2SiO3+2H2.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si+6OH--4e-=SiO32-+3H2O;
(2)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1.工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1;
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g).表为该反应在不同温度时的平衡常数.则:该反应的△H<0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为75%.
| 温度℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)负极发生氧化反应,Si在负极上失去电子,碱性条件下生成硅酸根与水,结合电荷守恒和原子守恒书写;
(2)根据盖斯定律书写目标热化学方程式;,已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1,
根据盖斯定律,①+②-③得到所需热化学方程式;
(3)由表中数据可知,升高温度,平衡常数减小,平衡向逆反应方向移动,正反应为放热反应;
CO和H2O起始浓度相等,令他们的浓度为1mol/L,设平衡时CO的浓度变化量为xmol/L,利用三段式表示出平衡时各组分的浓度,根据平衡常数列方程计算,进而计算CO转化率.
解答 解:(1)负极发生氧化反应,Si在负极上失去电子,碱性条件下生成硅酸根与水,负极电极反应式为:Si+6OH--4e-=SiO32-+3H2O,
故答案为:Si+6OH--4e-=SiO32-+3H2O;
(2)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1,
根据盖斯定律,①+②-③得:2C(s)+SiO2(s)=2CO(g)+Si(s)△H=(a+b-c) kJ•mol-1,
故答案为:2C(s)+SiO2(s)=2CO(g)+Si(s)△H=(a+b-c) kJ•mol-1;
(3)由表中数据可知,升高温度,平衡常数减小,平衡向逆反应方向移动,正反应为放热反应,即△H<0;
CO和H2O起始浓度相等,令他们的起始浓度为1mol/L,设平衡时CO的浓度变化量为xmol/L,则:
CO(g)+H2O(g)═H2(g)+CO2(g)
开始(mol/L):1 1 0 0
转化(mol/L):x x x x
平衡(mol/L):1-x 1-x x x
故 $\frac{{x}^{2}}{(1-x)^{2}}$=9,解得x=0.75,
故CO的转化率=$\frac{0.75mol/L}{1mol/L}$×100%=75%,
故答案为:<;75%.
点评 本题考查原电池、热化学方程式、化学平衡计算等,侧重对基础知识的巩固,负极电极反应式可以利用电荷守恒和原子守恒书写,难度不大.

| A. | 水的生成与水的电解是可逆反应 | |
| B. | 实验室用H2O2制O2,加入MnO2后,反应速率明显加快 | |
| C. | 反应2SO2+O2═2SO3中,可以通过改变反应条件让SO2、O2完全转化为SO3 | |
| D. | 金属钠与足量水反应,增加水的量能加快反应速率 |
| A. | 乙烯、溴苯分子中的所有原子均共平面 | |
| B. | 在有机物分子中,含有的氢原子个数一定是偶数 | |
| C. | 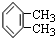 与 与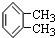 属于同种物质,说明苯分子中6个碳原子之间的键是完全一样的 属于同种物质,说明苯分子中6个碳原子之间的键是完全一样的 | |
| D. | CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构 |
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| A. | 3Q1+3Q2<2Q3 | B. | Q1+Q2<Q3 | C. | 3Q1+Q2<6Q3 | D. | 3Q1+Q2<2Q3 |

 请回答下列问题.
请回答下列问题. .
.
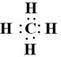 ,其空间构型为正四面体.
,其空间构型为正四面体.