题目内容
7.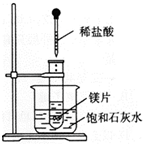 在一只试管中放入几小块镁片,把试管放入盛有25℃的饱和石灰水的烧杯中,用胶头滴管滴5mL盐酸于试管中.试回答下列问题:
在一只试管中放入几小块镁片,把试管放入盛有25℃的饱和石灰水的烧杯中,用胶头滴管滴5mL盐酸于试管中.试回答下列问题:(1)实验中产生的现象是:镁片逐渐溶解,有大量气泡产生,烧杯中有固体析出.
(2)写出有关的化学方程式:Mg+2HCl═MgCl2+H2↑.
(3)由实验推知:MgCl2溶液与H2的总能量<(填“<”“>”或“=”) Mg片和盐酸的总能量.
分析 (1)金属镁和酸反应生成盐和氢气;金属和酸的反应是放热反应,氢氧化钙的溶解度随着温度升高而降低,随着温度的降低而升高;
(2)金属镁和盐酸反应生成氯化镁和氢气;
(3)当反应物的能量高于生成物的能量,则反映是放热反应,反之是吸热反应.
解答 解:(1)金属镁和盐酸反应产生大量的热,冒气泡,金属镁和盐酸反应产生大量的热,该热量能使氢氧化钙的溶解度降低,所以饱和石灰水中溶液变浑浊,
故答案为:镁片逐渐溶解,有大量气泡产生,烧杯中有固体析出;
(2)金属镁和盐酸反应的实质是:Mg+2H+═Mg2++H2↑,故答案为:Mg+2H+═Mg2++H2↑;
(3)金属镁和盐酸反应产生大量的热,反应物的能量高于生成物的能量,故答案为:<.
点评 本题考查学生常见的放热反应和吸热反应以及氢氧化钙的溶解度随温度的变化关系,可以根据所学知识进行回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
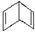
17.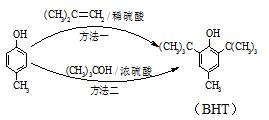 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从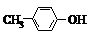 出发合成BHT的方法有如下两种.下列说法错误的是( )
出发合成BHT的方法有如下两种.下列说法错误的是( )
 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如下两种.下列说法错误的是( )
出发合成BHT的方法有如下两种.下列说法错误的是( )| A. | 从绿色化学角度分析方法一优于方法二 | |
| B. | BHT在水中的溶解度小于苯酚 | |
| C. | 两种方法的反应类型都是加成反应 | |
| D. | BHT与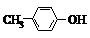 都能使酸性KMnO4溶液褪色 都能使酸性KMnO4溶液褪色 |
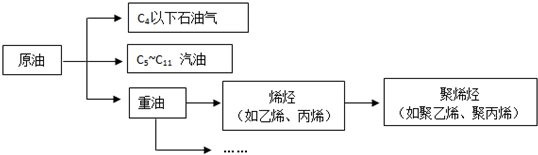
18.已知:乙烯可被酸性高锰酸钾溶液氧化为CO2.可以用来除去甲烷中混有的少量乙烯的操作方法是( )
| A. | 将混合气体通过盛有硫酸的洗气瓶 | |
| B. | 将混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 将混合气体通过盛有水的洗气瓶 | |
| D. | 将混合气体通过盛有酸性高锰酸钾的洗气瓶 |
12.下列反应方程式书写正确的是( )
| A. | 甲醛和足量银氨溶液充分反应:HCHO+2Ag(NH3)2++2O- $\stackrel{加热}{→}$ HCOO-+NH4++2Ag↓+H2O+3NH3 | |
| B. | 往苯酚钠溶液中通入少量二氧化碳气体: | |
| C. | 向盛有硫酸铜水溶液的试管里加入过量氨水:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O | |
| D. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ |
16.下列有关化学反应速率和限度的说法中,正确的是( )
| A. | 水的生成与水的电解是可逆反应 | |
| B. | 实验室用H2O2制O2,加入MnO2后,反应速率明显加快 | |
| C. | 反应2SO2+O2═2SO3中,可以通过改变反应条件让SO2、O2完全转化为SO3 | |
| D. | 金属钠与足量水反应,增加水的量能加快反应速率 |
17.关于下列有机物性质的说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |

 .
. ,其现象为酸性高锰酸钾溶液褪色.
,其现象为酸性高锰酸钾溶液褪色. 如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答:
如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答: ;B的最高价氧化物对应水化物的化学式为H2SO4.
;B的最高价氧化物对应水化物的化学式为H2SO4.