��Ŀ����
����Ŀ��ijѧϰС���о���Һ��Fe2+���ȶ��ԣ���������ʵ�飬��¼�����
��ʵ������
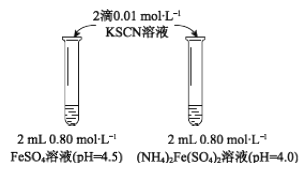
���� | 0 min | 1min | 1h | 5h |
FeSO4 | ����ɫ | �ۺ�ɫ | ��ɫ | ���ɫ |
(��NH4)2Fe(SO4)2 | ������ɫ | ����ɫ | ��ɫ | �ۺ�ɫ |
��1������(NH4)2Fe(SO4)2��ҺpHС��FeSO4��ԭ����_____________�������ӷ���ʽ��ʾ������Һ���ȶ��ԣ�FeSO4_______(NH4)2Fe(SO4)2����������������������
��2����ͬѧ���ʵ����������Һ���ȶ��Բ��������(NH4)2Fe(SO4)2��Һ�е�NH4+������Fe2+����ΪNH4+���л�ԭ�ԡ����С�ʵ�����������˸ù۵㣬�벹ȫ��ʵ�顣
���� | ���� |
ȡ__________,�μ�_______���۲졣 | ��ʵ������(NH4)2Fe(SO4)2��Һ������ͬ�� |
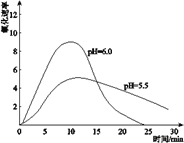
��3����ͬѧ�����ʵ������������Һ���ȶ��Բ�������Һ���Բ�ͬ���£����С�ʵ��III�����ֱ�����0.8 mol![]() L��pHΪ1��2��3��4��FeSO4��Һ���۲죬����pH��1��FeSO4��Һ��ʱ�������Ա仯��pHԽ��FeSO4��Һ��Ƶ�ʱ��Խ�̡�
L��pHΪ1��2��3��4��FeSO4��Һ���۲죬����pH��1��FeSO4��Һ��ʱ�������Ա仯��pHԽ��FeSO4��Һ��Ƶ�ʱ��Խ�̡�
������ʾ����������Һ�д��ڷ�Ӧ4Fe2+��O2��10H2O ![]() 4Fe(OH)3��8H+
4Fe(OH)3��8H+
�ɡ�ʵ��III������ͬѧ�ɵó�ʵ��Ľ�����___________________________��ԭ����___________________________________________________________��
��4����һ���о���ˮ��Һ��
��5���ۺ�����ʵ�飬��ǿFe2+�ȶ��ԵĴ�ʩ��__________________________��
��6������Һ�м���һ����H2O2����Fe2����Ϊȷ������H2O2������������K2Cr2O7����Һ�ζ���Һ�е�Fe2�������ӷ���ʽ���£�Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O��
������ζ���ע��K2Cr2O7����Һǰ���ζ�����Ҫ��©��������ˮϴ�Ӻ�_____________________��Ӧѡ��___________ʽ�ζ��ܡ�
�����ζ�xmL��Һ�е�Fe2��������amol��L��1K2Cr2O7����ҺbmL������Һ��c(Fe2��)=______mol��L-1��
���𰸡� NH4+��H2O![]() NH3��H2O��H+ �� ȡ2 mL pH��4.0��0.80 mol��L��1 FeSO4��Һ ��2��0.01 mol��L��1 KSCN��Һ ��ҺpHԽС��Fe2+Խ�ȶ� ��Һ�д���ƽ��4Fe2+��O2��10H2O
NH3��H2O��H+ �� ȡ2 mL pH��4.0��0.80 mol��L��1 FeSO4��Һ ��2��0.01 mol��L��1 KSCN��Һ ��ҺpHԽС��Fe2+Խ�ȶ� ��Һ�д���ƽ��4Fe2+��O2��10H2O ![]() 4Fe(OH)3��8H+�� c��H+����ƽ�����������ǿ��Fe2+���ȶ� ���ɵ�Fe(OH)3�Է�Ӧ�д����� ��һ��������ܷⱣ�� ���ظ������Һ��ϴ2-3�� ��ʽ 6ab/x
4Fe(OH)3��8H+�� c��H+����ƽ�����������ǿ��Fe2+���ȶ� ���ɵ�Fe(OH)3�Է�Ӧ�д����� ��һ��������ܷⱣ�� ���ظ������Һ��ϴ2-3�� ��ʽ 6ab/x
��������(1)FeSO4��Һ��ֻ��Fe2+��ˮ��ʹ��Һ�������ԣ���(NH4)2Fe(SO4)2��Һ��Fe2+��NH4+��ˮ��ʹ��Һ�������ԣ�����(NH4)2Fe(SO4)2��ҺpHС��FeSO4��Һ��pH����������NH4+��ˮ�⣬��Ӧ�����ӷ���ʽΪ NH4+��H2O![]() NH3��H2O��H+�����ݱ�����ɫ�ı仯����������FeSO4��Һ��KSCN��Һ��Ӧ1minʱ����ɫ��(NH4)2Fe(SO4)2��Һ��KSCN��Һ��Ӧ5h����ɫ��ͬ��˵��FeSO4���ȶ�������(NH4)2Fe(SO4)2��
NH3��H2O��H+�����ݱ�����ɫ�ı仯����������FeSO4��Һ��KSCN��Һ��Ӧ1minʱ����ɫ��(NH4)2Fe(SO4)2��Һ��KSCN��Һ��Ӧ5h����ɫ��ͬ��˵��FeSO4���ȶ�������(NH4)2Fe(SO4)2��
(2)��ͬѧ���ʵ���������Һ���ȶ��Բ��������(NH4)2Fe(SO4)2��Һ�е�NH4+������Fe2+����ô���ǿ���ȡ��(NH4)2Fe(SO4)2��Һ�����ͬ��Ũ����ͬ��pH��ͬ�IJ���NH4+��FeSO4��Һ���Ա�ʵ�顣��ȡ2 mL pH��4.0��0.80 mol��L��1 FeSO4��Һ����2��0.01 mol��L��1 KSCN��Һ����ʵ����ʵ��Ľ����ʵ�����(NH4)2Fe(SO4)2��Һ��ʵ��������ͬ��˵����û��NH4+�Ĵ��ڣ�ʵ������һ�������Ӷ����˼�ͬѧ�Ĺ۵㣻
(3)����ʵ��III�Ľ��˵��FeSO4��Һ�ĵ�pHԽС��FeSO4Խ�ȶ�����KSCN��Һ��ӦԽ���ף�������������Һ�д��ڵĻ�ѧƽ��4Fe2+��O2��10H2O ![]() 4Fe(OH)3��8H+��֪��pHԽС��c(H+)Խ��ƽ�����������Խ����FeSO4Խ�ȶ���
4Fe(OH)3��8H+��֪��pHԽС��c(H+)Խ��ƽ�����������Խ����FeSO4Խ�ȶ���
(4)������������Һ�д��ڵĻ�ѧƽ��4Fe2+��O2��10H2O ![]() 4Fe(OH)3��8H+���Ʋ������ɵ�Fe(OH)3�Է�Ӧ�д��������ҷ�Ӧ�������ɵ�c(H+)С���Է�Ӧ���������ú�С��
4Fe(OH)3��8H+���Ʋ������ɵ�Fe(OH)3�Է�Ӧ�д��������ҷ�Ӧ�������ɵ�c(H+)С���Է�Ӧ���������ú�С��
(5)�ۺ�����ʵ�飬��ǿFe2+�ȶ��ԵĴ�ʩ�����Ǽ���һ��������������c(H+)����С��Һ��pH��������ܷⱣ�棬����������ĽӴ��ȣ�
(6)������ζ���ע��K2Cr2O7����Һǰ����Ҫ�Եζ������ν��м�©��������ˮϴ�Ӻ���K2Cr2O7����Һ��ϴ2-3�Σ�����K2Cr2O7���������ԣ��ܹ������ܣ�����Ӧ����ʽ�ζ���ʢ��K2Cr2O7����Һ���ڸ�������K2Cr2O7����Һ�������Ũ�����n(K2Cr2O7)=amol��L-1��b��10-3L=ab��10-3mol�������ӷ���ʽ��n(Fe2��)=6ab��10-3mol������c(Fe2��) = ![]() =
=mol��L-1��

����Ŀ����15�֣�
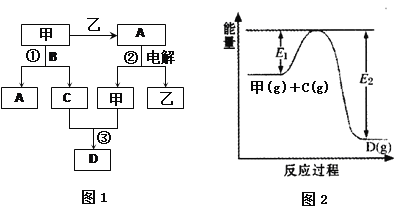
A��B��C��D������ѧ��ѧ�еij���������������ڱ�ǰ18��Ԫ����ɣ�DΪ����ɫ���壬�ס����������ֵ��ʣ����ϵ��ʺͻ�����֮������ͼ1��ʾ�ķ�Ӧ��ϵ����Ӧ������������ʡ�ԣ���
��ش��������⣺
��1��ͼ1��ʾת�������а����ķ�Ӧ������ ������ĸ����
a���û���Ӧ b�����ֽⷴӦ c���ֽⷴӦ d�����Ϸ�Ӧ
��2��ͼ1�з�Ӧ���Ļ�ѧ����ʽ�� ����3�֣�
��3��ͼ1�з�Ӧ����һ��������Ϊ���淴Ӧ����Ӧ�������仯��ͼ2��ʾ�����÷�Ӧ����ƽ��״̬ʱ�����д�ʩ�����������C��ƽ��ת���ʵ��� ������ĸ����
A�������¶� B�������¶� C������ѹǿ
D����Сѹǿ E��������� F������C����
��4������l.00 mol��2.00 mol C��ϳ����ݻ�Ϊ2 L���ܱ������У�3���Ӻ�Ӧ�ﵽƽ�⡣ƽ��������������ʵ���Ϊ2.55mol���üױ�ʾ�Ļ�ѧ��Ӧ����Ϊ
molL-1min-1��
��5���ݻ���Ϊ2 L���ĸ��ܱ������о������ţ�4���еķ�Ӧ��ij�¶��£����������ʵ�����mol�������淴Ӧ���ʹ�ϵ���±���ʾ��
������� | n(��) | n(C) | n (D) | v����v���Ĺ�ϵ |
�� | 0.20 | 0.10 | 0.20 | v����v�� |
�� | 0.20 | 0.40 | 1.00 | ��? |
�� | 0.60 | 1.20 | 0.80 | ��? |
��������ʽϵ��Ϊ��������ȣ�����¶��µ�ƽ�ⳣ��K=
��д���пո� �� ��
����Ŀ�����������ͬ��ijֲ��Ӫ��Һ�����䷽�ֱ����£�
KCl | K2SO4 | ZnSO4 | |
�� | 0.3 mol��L��1 | 0.2 mol��L��1 | 0.1 mol��L��1 |
�� | 0.1 mol��L��1 | 0.3 mol��L��1 | �� |
���ж�������Ӫ��Һ�ɷֵķ�������ȷ����(����)
A. K�������ʵ�����ͬ
B. Cl�������ʵ�����ͬ
C. ��ȫ��ͬ
D. SO![]() �����ʵ�����ͬ
�����ʵ�����ͬ
����Ŀ������̼ѭ������������ĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ����ԡ���̼���á�����Ϊ��ѧ���о�����Ҫ���⡣
(1)�õ绡���ϳɵĴ�������̼�ܳ����д�����̼�����������ʣ������ֿ������������������ᴿ������ɸ÷�Ӧ�Ļ�ѧ����ʽ��
___ C+ ___ KMnO4+ H2SO4 �� ____CO2��+ ____MnSO4 + ____K2SO4+
(2)����ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g)![]() CO2(g)��H2(g)���õ����¶������ݣ�
CO2(g)��H2(g)���õ����¶������ݣ�
ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
��ʵ��1����CO2��ʾ�Ļ�ѧ��Ӧ����Ϊ__________������С������λ������ͬ����
��ʵ��2������ƽ�ⳣ��K=_________���÷�ӦΪ _____��������š����ȷ�Ӧ��
(3)��֪�ڳ��³�ѹ�£�
�� 2CH3OH(l)��3O2(g) �� 2CO2(g)��4H2O(g) ��H �� ��1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H �� ��566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H �� ��44.0 kJ��mol
д���״�����ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ����ʽ��_____________��
(4)ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�á�

�ٸõ�ظ����ĵ缫��ӦΪ��_______________��
�ڸõ�ع���ʱ����Һ�е�OH����______���ƶ���

