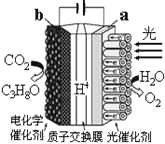
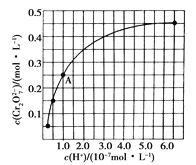
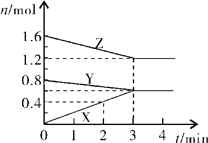
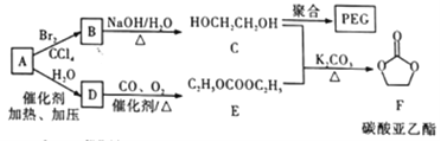
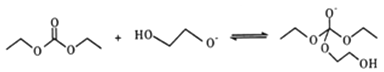
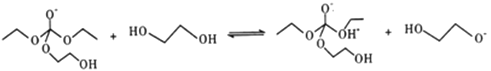
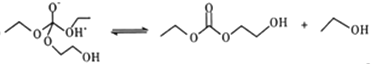
题目内容
【题目】甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲的单质与水反应的离子方程式为__________________。
(2)乙元素在周期表中的位置为__________________。
(3)丙元素的最高价氧化物的电子式为__________________。
(4)甲与丁两种元素可组成的具有强氧化性的物质是__________(填化学式)。
【答案】2Na+2H2O=2Na++2OH-+H2↑第三周期ⅡA族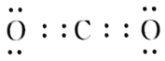 Na2O2
Na2O2
【解析】
甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等,则乙为Mg;甲原子的核外电子数比乙原子核外电子数少1,则甲含有11个电子,甲为Na;丙原子的最外层电子数是次外层电子数的2倍,则丙为C;丁原子核电荷数比丙原子核电荷数多2,则丙的核电荷数为8,所以丁为O。结合元素周期律解答。
根据以上分析可知甲为Na,乙为Mg,丙为C,丁为O,则
(1)甲为Na,与水反应反应生成氢气和氢氧化钠,其离子方程式为2Na+2H2O=2Na++2OH-+H2↑;
(2)乙为Mg,Mg在周期表中位于第三周期ⅡA族;
(3)丙为C,丙元素的最高价氧化物为二氧化碳,其电子式为![]() ;
;
(4)甲和丁分别为Na和O,二者反应生成的Na2O2具有强氧化性。

 名校课堂系列答案
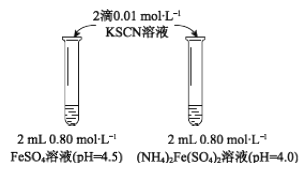
名校课堂系列答案【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,记录结果。
【实验Ⅰ】
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
((NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_____________(用离子方程式表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行【实验Ⅱ】,否定了该观点,请补全该实验。
操作 | 现象 |
取__________,滴加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出【实验Ⅰ】中两溶液的稳定性差异是溶液酸性不同导致,进行【实验III】,分别配制0.8 mol![]() L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由【实验III】,乙同学可得出实验的结论是___________________________,原因是___________________________________________________________。
(4)进一步研究在水溶液中
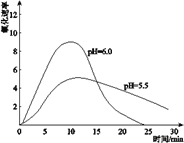
(5)综合以上实验,增强Fe2+稳定性的措施有__________________________。
(6)向溶液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、用蒸馏水洗涤和_____________________,应选用___________式滴定管。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1K2Cr2O7标准溶液bmL,则滤液中c(Fe2+)=______mol·L-1。