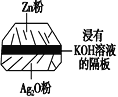
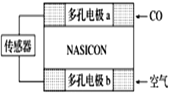
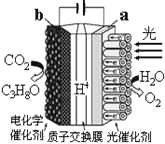
题目内容
【题目】现有三种液态混合物:①乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃);②汽油和水③溴水.在实验室分离这三种混合物的正确方法依次为( )
A.蒸馏、分液、萃取
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
【答案】A
【解析】解:①乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的沸点不同,故可以用蒸馏的方法来分离;
②汽油和水互不相溶,故可以用分液的方法来分离;
③溴在水的溶解度小于在有机溶液中的溶解度,故可以用有机溶剂(如四氯化碳或苯)来萃取水中的溴.
故选A.

【题目】生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5 L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 25.00 | 342 |
硫酸钾(K2SO4) | 0.25 | 174 |
高锰酸钾(KMnO4) | 0.25 | 158 |
阿司匹林(C9H8O4) | 0.17 | 180 |
硝酸银(AgNO3) | 0.02 | 170 |
(1)鲜花保鲜剂的下列成分中,属于电解质的是________(填字母)。
a.蔗糖 b.硫酸钾
c.高锰酸钾 d.硝酸银
(2)欲配制480 mL该鲜花保鲜剂,现已提供下列仪器:
①胶头滴管、②量筒、③烧杯、④药匙、⑤电子天平,如要完成实验,缺少的玻璃仪器还有________(写仪器名称)。
(3)写出该鲜花保鲜剂中K+的物质的量浓度的计算式:________(不必化简)。
(4)将m g蔗糖完全燃烧后的产物通过足量的Na2O2固体,充分反应后,固体增加的质量________(填“>”“=”或“<”)m g。
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,记录结果。
【实验Ⅰ】
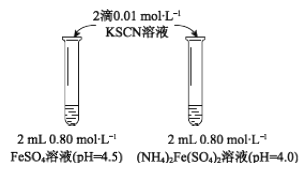
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
((NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_____________(用离子方程式表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行【实验Ⅱ】,否定了该观点,请补全该实验。
操作 | 现象 |
取__________,滴加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出【实验Ⅰ】中两溶液的稳定性差异是溶液酸性不同导致,进行【实验III】,分别配制0.8 mol![]() L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由【实验III】,乙同学可得出实验的结论是___________________________,原因是___________________________________________________________。
(4)进一步研究在水溶液中
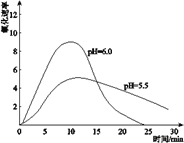
(5)综合以上实验,增强Fe2+稳定性的措施有__________________________。
(6)向溶液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、用蒸馏水洗涤和_____________________,应选用___________式滴定管。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1K2Cr2O7标准溶液bmL,则滤液中c(Fe2+)=______mol·L-1。