题目内容
【题目】根据下列图示得出的结论不正确的是( )
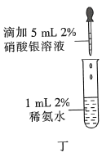
A.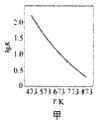 图甲是CO(g)+H2O(g)
图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
B.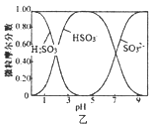 图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
C. 图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
D.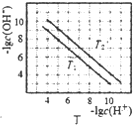 图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
【答案】C
【解析】
A.根据图知,升高温度,化学平衡常数减小,说明平衡逆向,升高温度平衡向吸热方向移动,则逆反应是吸热反应,正反应是放热反应,即正反应△H<0,故A正确;
B.根据图象分析,pH=4时,溶液中主要存在为HSO3-,所以当pH=4时应停止通入SO2,控制pH,主要得到NaHSO3,故B正确;
C.盐酸溶液pH小于一水合氨,稀释过程中盐酸溶液pH增大,溶液的pH大小关系:b>d>c,故C错误;
D.-lgc(H+)、-lgc(OH-)的乘积越大,水的电离程度越小,可知T1<T2,故D正确,
故选:C。

【题目】近几年来关于氮污染的治理备受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。
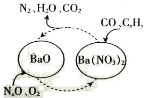
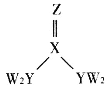
若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:_______________________。从最终排放的气体来看,氮元素将_______________________(填“被氧化”或“被还原”)。
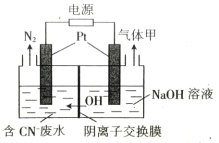
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将_______________________(填“增大”、“减小”或“不变”)。阳极的电极反应式为_______________________。
(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO![]() N2+2CO2 ΔH
N2+2CO2 ΔH
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能(kJ/mol) | 1076 | 630 | 945 | 803 |
①ΔH=_________________kJ/mol
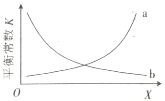
②该反应的平衡常数与外界因素X[代表温度、压强、![]() 或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g)![]() 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
①n=_____________________________;
②v(NO)=_______________;
③NH3的平衡转化率为_______________。
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 原子最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)E元素在周期表中的位置是_________________________。
(2)写出D元素基态原子的简化电子排布式:__________。
(3)这5种元素中电负性最大的元素是__________(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为_______________________(填元素符号)。
(4)B、C、D的简单离子的半径由大到小的顺序为____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式:_____________________。
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次从左至右发生的反应类型和反应条件都正确的是 ( )
选项 | 反应类型 | 反应条件 |
A | 加成反应;取代反应;消去反应 | KOH醇溶液 |
B | 消去反应;加成反应;取代反应 | NaOH水溶液 |
C | 氧化反应;取代反应;消去反应 | 加热;KOH醇溶液 |
D | 消去反应;加成反应;水解反应 | NaOH醇溶液 |
A.AB.BC.CD.D