题目内容
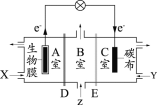
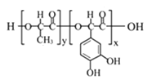
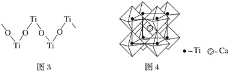
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示:
且W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是
A.YW3分子中的键角为120°
B.W2Z的稳定性大于YW3
C.物质甲分子中存在6个σ键
D.Y元素的氧化物对应的水化物为强酸
【答案】B
【解析】
短周期主族元素W、X、Y、Z的原子序数逐渐增大,根据四种元素形成的化合物结构,其中各原子的核外电子排布均处于稳定结构。根据图示可知,X原子最外层含有4个电子,Y原子最外层含有5个电子,Z原子最外层含有6个电子,W最外层含有1个或7个电子,结合原子序数及“W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体”可知,W为H,X为C,Y为N,Z为O元素,据此分析解答。
根据分析可知,W为H,X为C,Y为N,Z为O元素。
A.YW3为NH3,为三角锥形的分子,分子中的键角<120°,故A错误;
B.非金属性越强,氢化物越稳定,水的稳定性大于氨气,故B正确;
C.物质甲的结构简式为CO(NH2)2,存在7个σ键和1个π键,故C错误;
D.N元素的氧化物对应的水化物可能是硝酸,也可能为亚硝酸,其中亚硝酸为弱酸,故D错误;
故选B。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】用下列装置能达到实验目的的是
A |
| 淸洗铜与浓硫 酸反应后有残 液的试管 | B |
| 配置一定物质的量浓度的溶液实验中,为定容时的操作 |
C |
| 以淀粉为指示 剂,用酸式滴 定管盛放 Na2S2O3标准溶液进行滴定 | D |
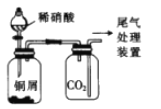
| 装置为制备并用 排气法收集NO 气体的装置(稀硝酸+钢屑) |
A. AB. BC. CD. D
【题目】某小组研究铁与水蒸气的反应,两位同学分别进行了如下实验。
实验Ⅰ | 实验Ⅱ |
|
|
请回答:
(1)实验Ⅰ中湿棉花的作用是______________。
(2)实验Ⅰ中反应的化学方程式是__________。
(3)甲同学观察到实验Ⅰ中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有___________。
(4)乙同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是____________。
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:

小组记最的实验现象如下表所示:
开始时 | 5min 后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是_______________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是____________________________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV;分别取少量 5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。试用方程式解释溶液中出现Fe2+的原因______________________________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与SO32-的氧化还原反应:
②NO3-可以______________________________;
③NO3-在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(己知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mLpH=1.0的0.4mol/L Fe(NO3)3溶液中溶解 固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mLpH=1.0的稀硝酸中溶解约0.19gNaNO3固体,再加 入2滴0.4mol/LNa2SO3溶液。向其中滴入少量BaCl2溶液 | _______________________。 |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述时间,以下结果或推论合理的是_______________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验1的上层淸液中是否存在SO42-