题目内容
【题目】近几年来关于氮污染的治理备受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。
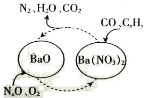
若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:_______________________。从最终排放的气体来看,氮元素将_______________________(填“被氧化”或“被还原”)。
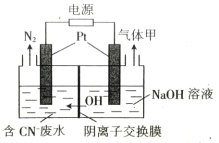
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将_______________________(填“增大”、“减小”或“不变”)。阳极的电极反应式为_______________________。
(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO![]() N2+2CO2 ΔH
N2+2CO2 ΔH
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能(kJ/mol) | 1076 | 630 | 945 | 803 |
①ΔH=_________________kJ/mol
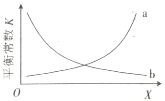
②该反应的平衡常数与外界因素X[代表温度、压强、![]() 或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g)![]() 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
①n=_____________________________;
②v(NO)=_______________;
③NH3的平衡转化率为_______________。
【答案】NO+NO2+BaO+O2= Ba(NO3)2 被还原 增大 2CN--10e-+12OH-=2CO![]() +N2↑+6H2O -745 温度 b 1.25 0.15mol·L-1·min-1 75%
+N2↑+6H2O -745 温度 b 1.25 0.15mol·L-1·min-1 75%
【解析】
(1)根据题意可知反应物为NO、NO2、BaO、O2,且NO和NO2系数比为1:1产物为Ba(NO3)2,根据电子守恒和元素守恒可得化学反应方程式为NO+NO2+BaO+O2= Ba(NO3)2;最终产物中N元素的存在形式为N2,所以氮元素将被还原;
(2)电解过程CN-转变为N2,氮元素化合价升高发生氧化反应,所以产生左侧为电解池的阳极,氮元素被氧化的同时碳元素也被氧化,由于阴极区的氢氧根会迁移到阳极区,所以碳元素的最终存在形式为碳酸根,电极反应式为2CN--10e-+12OH-=2CO![]() +N2↑+6H2O;右侧为电解池的阴极,水电离出的氢离子放电产生氢气,同时会产生氢氧根,电极反应式为2H2O+2e-=H2↑+2OH-,水减少导致NaOH溶液浓度变大,pH增大;
+N2↑+6H2O;右侧为电解池的阴极,水电离出的氢离子放电产生氢气,同时会产生氢氧根,电极反应式为2H2O+2e-=H2↑+2OH-,水减少导致NaOH溶液浓度变大,pH增大;
(3)①焓变=反应物键能之和-生成物键能之和,所以该反应的ΔH=2×630kJ/mol+2×1076kJ/mol-945kJ/mol-4×803kJ/mol=-745kJ/mol;
②平衡常数只与温度有关,所以X时温度;该反应焓变小于零,正反应为放热反应,所以温度升高平衡常数减小,则曲线b可以正确表达平衡常数随温度的变化;
(4)①容器体积为2L,根据题意列三段式为:

则有2-8x=0.5,所以8x=1.5,则有0.5n-2x=0.5n-0.375=0.25,解得n=1.25;
②根据三段式可知10min内Δc(NO)=1.5mol/L,所以v(NO)=![]() =0.15mol·L-1·min-1;
=0.15mol·L-1·min-1;
③NH3的平衡转化率为![]() ×100%=75%。
×100%=75%。

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法不正确的是
A.该反应为放热反应
B.容器I达到平衡所需要的时间比容器Ⅲ短
C.达到平衡时,容器I中的CH3OH体积分数大于容器Ⅱ
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行