题目内容
15.金属和非金属材料被广泛应用于人类生产生活中.如世博会中国馆是由钢筋混凝土、红色铝板和玻璃等建成.(1)铝单质表面易形成致密的氧化膜,工业上常用碱液洗涤除氧化物,反应离子方程式为Al2O3+2OH-═2AlO2-+H2O
(2)在隔绝空气的条件下,用镁条引燃四氧化三铁粉末和铝粉的均匀混合物,使其发生铝热反应,铝粉与四氧化三铁粉末反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
(3)玻璃的主要成分为SiO2.玻璃易被烧碱腐蚀,原因为SiO2+2OH-═SiO32-+H2O(用离子方程式表示)
(4)生产硅酸盐水泥和普通玻璃都需要用到的主要原料是CaCO3.
分析 (1)氧化铝是两性氧化物溶于强酸强碱;
(2)因铝热反应是铝和金属氧化反应得到金属和氧化铝;
(3)石英玻璃的主要成分是SiO2,酸性氧化物与碱反应生成盐和水;
(4)根据制备水泥和玻璃的原料分析;
解答 解:(1)氧化铝是两性氧化物和强酸强碱反应,氧化铝与氢氧化钠溶液作用生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O;故答案为:Al2O3+2OH-═2AlO2-+H2O;
(2)因铝热反应是铝和金属氧化反应得到金属和氧化铝,化学方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3;
(3)石英玻璃的主要成分是SiO2,酸性氧化物与碱反应生成盐和水,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,故答案为:SiO2;SiO2+2OH-═SiO32-+H2O;(4)制备水泥的原料是粘土、石灰石;制备玻璃的原料是纯碱、石灰石、石英,所以都用到CaCO3,故答案为:CaCO3.
点评 本题考查了几种常见的材料,同时涉及Al和二氧化硅的性质,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
6.下列说法正确的是( )
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 没有氧元素参加的反应一定不是氧化还原反应 |
3.“类推”是一种重要的学习方法,但有时会产生错误结论,下列类推结论中正确的是( )
| A. | 碱金属氟化物的晶格能顺序是LiF>NaF>KF>RbF>CsF;则钠的卤化物的晶格能顺序是NaF>NaCl>NaBr>NaI | |
| B. | ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序是AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | 若盐酸的浓度是醋酸浓度的2倍;则盐酸中H+浓度也是醋酸中H+浓度的2倍 |
10.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+O2(气)═CO2(气)△H1 C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$ Cl2(气)═HCl(气)△H2 |
20.25℃时几种难溶电解质的溶解度如表所示:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水.
(3)②中除去Fe3+所发生的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水.
(3)②中除去Fe3+所发生的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
7.如图中,表示正反应是放热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
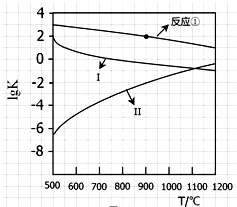 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
. 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题: