题目内容
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是( )
①a-b=m-n ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物的碱性X>Y.
①a-b=m-n ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物的碱性X>Y.
| A、②③ | B、③ |
| C、①②③④ | D、①②③ |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:四种短周期元素的离子aXm+、bYn+、cZn-和dRm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,故原子序数大小顺序是:a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,在同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的金属性随着原子序数的增大而减小,元素的金属性越强,其最高价氧化物的水化物碱性越强,据此答题.
解答:
解:四种短周期元素的离子aXm+、bYn+、cZn-和dRm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,故原子序数大小顺序是a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,
①离子aXm+、bYn+具有相同的电子层结构,则离子具有相同的电子数,即a-m=b-n,故①正确;
②由题意可知,具有相同的电子层结构,根据阴前阳后,X、Y在下一周期,Z、R在上一周期,若m>n,则Y在X的前面,R在Z的前面,所以元素的原子序数为a>b>c>d,故②正确;
③Z、R为上一周期的非金属元素,且元素的原子序数的离子c>d,在同一周期元素非金属性从左向右在增强,即非金属性Z>R,故③正确;
④四种主族元素中X、Y为下一周期的金属元素,且元素的原子序数a>b,在同一周期元素的金属性从左向右在减弱,即金属性Y>X,则最高价氧化物对应水化物碱性Y>X,故④错误;
故选D.
①离子aXm+、bYn+具有相同的电子层结构,则离子具有相同的电子数,即a-m=b-n,故①正确;
②由题意可知,具有相同的电子层结构,根据阴前阳后,X、Y在下一周期,Z、R在上一周期,若m>n,则Y在X的前面,R在Z的前面,所以元素的原子序数为a>b>c>d,故②正确;
③Z、R为上一周期的非金属元素,且元素的原子序数的离子c>d,在同一周期元素非金属性从左向右在增强,即非金属性Z>R,故③正确;
④四种主族元素中X、Y为下一周期的金属元素,且元素的原子序数a>b,在同一周期元素的金属性从左向右在减弱,即金属性Y>X,则最高价氧化物对应水化物碱性Y>X,故④错误;
故选D.
点评:本题考查学生利用离子的电子层结构相同来分析元素的位置及性质,中等难度,答题时注意元素周期律的灵活运用.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
如果按照某种标准能将FeSO4、Na2SO3、NO2划归为同一类物质,则下列物质中也能划归为此类物质的是( )
| A、KMnO4 |
| B、Al2(SO4)3 |
| C、KClO3 |
| D、K2HPO4 |
A、B、C、D、E五种元素同周期从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下: ,下列说法中正确的是( )
,下列说法中正确的是( )
 ,下列说法中正确的是( )
,下列说法中正确的是( )| A、D元素的负化合价为-2价时,E元素的最高化合价一定为+7 |
| B、B(OH)m为强碱时,A(OH)n也一定为强碱 |
| C、HnDOm为强酸时,E的非金属性一定很强 |
| D、HnCOm为强酸时,E的单质可能有强还原性 |
X、Y、Z为三种短周期元素,X、Y处在相邻的两个周期,X原子的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子与Y原子的最外层电子数之差为3.下列叙述正确的是( )
| A、X、Y、Z三种元素不能组成一种盐 |
| B、X单质与Z单质直接反应可生成两种化合物 |
| C、X、Y、Z的最高价氧化物对应的水化物,可能是酸、碱或两性的物质 |
| D、X、Y形成的一种离子跟H+反应可生成Y的离子 |



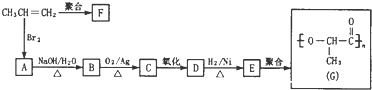
 ,反应④的化学方程式是
,反应④的化学方程式是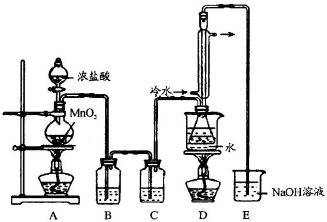 是工业上常用的硫化剂,实验室制备的方法有2种:
是工业上常用的硫化剂,实验室制备的方法有2种: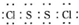 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下: