题目内容
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究性学习小组用粗铜(含杂质Fe)按图1所示流程制备氯化铜晶体(CuCl2?H2O).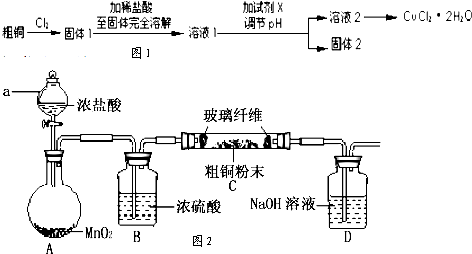
请回答下列问题:
(1)实验室采用如图2所示的装置制取固体l(加热仪器和夹持装置已略去).
①仪器a的名称是 ;装置B中的试剂为 .
②装置A中反应的离子方程式为 .
③装置D中的试剂为 ,其作用是 .
(2)在除去溶液1中的Fe3+时,加入试剂X用于调节pH以除去杂质.
①X可选用下列试剂中的 (填字母代号).
A.Na2CO3 B.NH3?H2O C.CuO D.CuSO4
②为使CuCl2溶液中的Fe3+完全除去,根据如表数据,溶液pH范围应保持在 .
当溶液的pH=4时,c(Fe3+)= mol/L.[Fe(OH)3的Ksp=4.0×10-38]
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.已知如下转化关系:
Cu(H2O)
(aq)+4Cl-(aq)?CuCl
(aq)+4H2O(l)
请设计合理的实验方案证明CuCl2溶液中存在上述转化关系: .

请回答下列问题:
(1)实验室采用如图2所示的装置制取固体l(加热仪器和夹持装置已略去).
①仪器a的名称是
②装置A中反应的离子方程式为
③装置D中的试剂为
(2)在除去溶液1中的Fe3+时,加入试剂X用于调节pH以除去杂质.
①X可选用下列试剂中的
A.Na2CO3 B.NH3?H2O C.CuO D.CuSO4
②为使CuCl2溶液中的Fe3+完全除去,根据如表数据,溶液pH范围应保持在
当溶液的pH=4时,c(Fe3+)=
| 离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
Cu(H2O)
2+ 4 |
2- 4 |
请设计合理的实验方案证明CuCl2溶液中存在上述转化关系:
考点:制备实验方案的设计,难溶电解质的溶解平衡及沉淀转化的本质,铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:(1)粗铜为Fe、Cu的混合物,与氯气反应生成固体1的主要成分为CuCl2和FeCl3,实验室采用如图2所示的装置制取固体l,制备原理为二氧化锰和浓盐酸在加热条件下反应生成氯气,应浓硫酸干燥后与粗铜在加热条件下反应生成CuCl2和FeCl3,多于的氯气用氢氧化钠溶液吸收,以防污染空气;
(2)除去CuCl2和FeCl3混合溶液中的Fe3+,应调节溶液pH3.2~4.7之间,可加入CuO、Cu(OH)2、CuCO3等物质,注意不能引入新的杂质;
(3)Cu(H2O)42+为蓝色,CuCl42-为黄色,溶液颜色由蓝色变为绿色,可改变Cu(H2O)42+或CuCl42-的浓度.
(2)除去CuCl2和FeCl3混合溶液中的Fe3+,应调节溶液pH3.2~4.7之间,可加入CuO、Cu(OH)2、CuCO3等物质,注意不能引入新的杂质;
(3)Cu(H2O)42+为蓝色,CuCl42-为黄色,溶液颜色由蓝色变为绿色,可改变Cu(H2O)42+或CuCl42-的浓度.
解答:
解:(1)①由装置图可知a为分液漏斗,b中的试剂为浓硫酸,故答案为:分液漏斗;浓硫酸;
②二氧化锰和浓盐酸在加热条件下反应生成氯气,反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
③装置D中的试剂为氢氧化钠溶液,可用于吸收多余的氯气,生成氯化钠和此次氯酸钠,防止污染环境,
故答案为:NaOH溶液; 吸收多余的氯气,防止污染空气;
(2)①可加入CuO、Cu(OH)2、CuCO3等物质,注意不能引入新的杂质,题中只有C符合,故答案为:C;
②为使CuCl2溶液中的Fe3+完全除去,应调节溶液pH介于3.2~4.7之间,可保证Fe3+完全除去,而不影响Cu2+,
当溶液的pH=4时,c(OH-)=1×10-10 mol?L-1,则c(Fe3+)=
mol?L-1=4.0×10-8 mol?L-1,
故答案为:3.2~4.7;4.0×10-8;
(3)Cu(H2O)42+为蓝色,CuCl42-为黄色,溶液颜色由蓝色变为绿色,如取氯化铜晶体配制成蓝绿色溶液,然后向溶液中加水稀释,溶液变为蓝色或向溶液中加入CuCl2晶体,溶液变为绿色,可证明溶液中存在Cu(H2O)42+(aq)+4Cl-(aq)?CuCl42-(aq)+4H2O(l)的平衡,
故答案为:取氯化铜晶体配制成蓝绿色溶液,然后向溶液中加水稀释,溶液变为蓝色;或向溶液中加入CuCl2晶体,溶液变为绿色等.
②二氧化锰和浓盐酸在加热条件下反应生成氯气,反应的离子方程式为MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
③装置D中的试剂为氢氧化钠溶液,可用于吸收多余的氯气,生成氯化钠和此次氯酸钠,防止污染环境,
故答案为:NaOH溶液; 吸收多余的氯气,防止污染空气;
(2)①可加入CuO、Cu(OH)2、CuCO3等物质,注意不能引入新的杂质,题中只有C符合,故答案为:C;
②为使CuCl2溶液中的Fe3+完全除去,应调节溶液pH介于3.2~4.7之间,可保证Fe3+完全除去,而不影响Cu2+,
当溶液的pH=4时,c(OH-)=1×10-10 mol?L-1,则c(Fe3+)=
| 4.0×10-38 |
| (1.0×10-10)3 |
故答案为:3.2~4.7;4.0×10-8;
(3)Cu(H2O)42+为蓝色,CuCl42-为黄色,溶液颜色由蓝色变为绿色,如取氯化铜晶体配制成蓝绿色溶液,然后向溶液中加水稀释,溶液变为蓝色或向溶液中加入CuCl2晶体,溶液变为绿色,可证明溶液中存在Cu(H2O)42+(aq)+4Cl-(aq)?CuCl42-(aq)+4H2O(l)的平衡,
故答案为:取氯化铜晶体配制成蓝绿色溶液,然后向溶液中加水稀释,溶液变为蓝色;或向溶液中加入CuCl2晶体,溶液变为绿色等.
点评:本题考查学生对工艺流程理解、实验装置的理解、平衡移动、平衡常数,物质分离提纯等,难度中等,需要学生具有基本扎实的基础与综合运用能力,(2)中②可以根据借助溶度积常数进行计算.

练习册系列答案
相关题目
13.5g金属铝与1L 2mol?L-1NaOH溶液充分反应,生成的气体在标准状况下的体积为( )
| A、11.2L |
| B、22.4L |
| C、16.8L |
| D、44.8L |
下列措施一定不能加快化学反应速率的是( )
| A、升高温度 |
| B、降低温度 |
| C、加入催化剂 |
| D、增大反应物浓度 |
下列说法中,正确的是( )
| A、钠、钾着火时可用水灭火 |
| B、面粉厂或加油站不必严禁烟火 |
| C、氨气泄漏时可喷洒大量水进行处理 |
| D、节日期间可在人群聚集的闹市燃放烟花爆竹 |
