题目内容
19.(1)在同温同压下,体积相同的CO、C2H4和C3H6三种气,物质的量之比为1:1:1,质量之比为2:2:3,密度之比为2:2:3,碳原子数之比为1:2:3,所含质子数之比为7:8:12.(2)已知反应4Zn+10HNO3═4Zn(NO3)2+NH4NO3+3H2O 该反应的还原剂是Zn,还原产物是NH4NO3,氧化剂与还原剂的物质的量之比是1:4,若有2mol HNO3被还原,转移的电子数是16NA.
(3)写出下列反应的离子方程式
①过量Ca(HCO3)2溶液与少量NaOH溶液反应Ca2++HCO3-+OH-=CaCO3↓+H2O;
②Na2CO3溶液中通入CO2气体CO32-+H2O+CO2=2HCO3-;
③NH4HCO3溶液中加入过量NaOH溶液并加热反应NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-;
④向AlCl3溶液中加入过量NaOH溶液:Al3++4OH-=AlO2-+2H2O.
分析 (1)同温同压下,Vm相同,体积相同时物质的量相同,结合m=nM及分子构成、密度之比等于摩尔质量之比计算;
(2)4Zn+10HNO3═4Zn(NO3)2+NH4NO3+3H2O中,Zn元素的化合价升高,N元素的化合价降低;
(3)①反应生成碳酸钙、碳酸氢钠和水;
②反应生成碳酸氢钠;
③反应生成碳酸钠、氨气、水;
④反应生成偏铝酸钠和氯化钠、水.
解答 解:(1)同温同压下,Vm相同,体积相同时物质的量相同,则CO、C2H4和C3H6三种气体的物质的量之比为1:1:1,质量比为1×28:1×28:1×42=2:2:3,密度之比等于摩尔质量之比为2:2:3,由分子构成可知碳原子数之比为1:1×2:1×3=1:2:3,含质子数之比为1×14:1×16:1×24=7:8:12,
故答案为:1:1:1;2:2:3; 2:2:3;1:2:3;7:8:12;
(2)4Zn+10HNO3═4Zn(NO3)2+NH4NO3+3H2O中,Zn元素的化合价升高,N元素的化合价降低,则该反应的还原剂是Zn,N得到电子被还原,对应还原产物是NH4NO3,只有1mol酸作氧化剂,则氧化剂与还原剂的物质的量之比是1:4,若有2mol HNO3被还原,转移的电子数是2mol×8×NA=16NA,
故答案为:Zn;NH4NO3;1:4;16
(3)①反应生成碳酸钙、碳酸氢钠和水,离子反应为Ca2++HCO3-+OH-=CaCO3↓+H2O,故答案为:Ca2++HCO3-+OH-=CaCO3↓+H2O;
②反应生成碳酸氢钠,离子反应为CO32-+H2O+CO2=2HCO3-,故答案为:CO32-+H2O+CO2=2HCO3-;
③反应生成碳酸钠、氨气、水,离子反应为NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,故答案为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-;
④反应生成偏铝酸钠和氯化钠、水,离子反应为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
点评 本题考查离子反应方程式、氧化还原反应及物质的量计算,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. |  根据图可判断可逆反应A2(g)+3B2(g)═2AB3(g)的△H>0 | |
| B. | 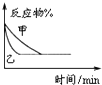 表示压强对可逆反应2A(g)+2B(g)═3C(g)+D(s)的影响,乙的压强大 | |
| C. | 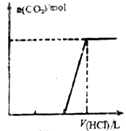 表示在含等物质的量NaOH、Na2CO3的混合溶液中逐滴加入0.1mol/L盐酸至过量时,产生气体的物质的量与消耗盐酸的体积关系 | |
| D. | 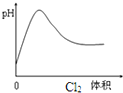 表示Cl2通入H2S溶液中pH变化 |
| A. | Si可用于制造半导体材料 | |
| B. | 二氧化硫可广泛用于食品的增白 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 84消毒液的有效成分是NaClO,可用于环境的消毒杀菌 |
| A. | 合金都只是由两种或多种金属熔合而成的 | |
| B. | 青铜、黄铜、白铜都是合金 | |
| C. | 合金属于纯净物 | |
| D. | 钢不属于合金 |
| A. | a>b>c | B. | c>a>b | C. | b>a>c | D. | a>c>b |
| A. | 常温下干燥的Cl2能用钢瓶贮运 | |
| B. | 检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 | |
| C. | 自然界中不存在游离态硅 | |
| D. | HF溶液不能贮存在磨口玻璃塞的试剂瓶中 |
| A. | 原子半径:W>Z>Y | |
| B. | 元素W最高价氧化物的水化物为强酸 | |
| C. | 化合物X2Y、Z2Y中化学键的类型相同 | |
| D. | 元素Y的简单气态氢化物的热稳定性比W的弱 |
| A. | 该条件下,钠的还原性强于C | |
| B. | 若CO2过量,则有Na2CO3生成 | |
| C. | 该反应中化学能除转化为热能外,还转化为电能 | |
| D. | Na2O是离子化合物,其中离子半径:r(Na+)>r(O2-) |