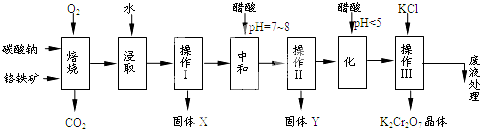
题目内容
NA为阿伏伽德罗常数,下列说法正确的是( )
| A、常温常压下,22.4L CO2中含有NA个CO2分子 |
| B、17.6g丙烷中所含的极性共价键为4NA个 |
| C、1.7g H2O2中含有的电子数为0.9NA |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、常温常压下,22.4LCO2不是1mol;
B、17.6g丙烷的物质的量是0.4mol,还原0.4mol×8=3.2mol极性键;
C、双氧水是18电子微粒,1.7g双氧水是0.05mol,还原0.9mol电子;
D、氧化剂为KIO3,I的化合价+5→0生成3mol I2时消耗1molKIO3,转移电子的物质的量为1mol×5=5mol.
B、17.6g丙烷的物质的量是0.4mol,还原0.4mol×8=3.2mol极性键;
C、双氧水是18电子微粒,1.7g双氧水是0.05mol,还原0.9mol电子;
D、氧化剂为KIO3,I的化合价+5→0生成3mol I2时消耗1molKIO3,转移电子的物质的量为1mol×5=5mol.
解答:
解:A、常温常压下,22.4LCO2不是1mol,因此分子数不是NA个,故A错误;
B、17.6g丙烷的物质的量是
=0.4mol,还原0.4mol×8=3.2mol极性键,故B错误;
C、双氧水是18电子微粒,1.7g双氧水是
=0.05mol,含有0.9mol电子,电子数为0.9NA,故C正确;
D、氧化剂为KIO3,I的化合价+5→0生成3mol I2时消耗1molKIO3,转移电子的物质的量为1mol×5=5mol,因此转移的电子数为5NA,故D错误;
故选C.
B、17.6g丙烷的物质的量是
| 17.6g |
| 44g/mol |
C、双氧水是18电子微粒,1.7g双氧水是
| 1.7g |
| 34g/mol |
D、氧化剂为KIO3,I的化合价+5→0生成3mol I2时消耗1molKIO3,转移电子的物质的量为1mol×5=5mol,因此转移的电子数为5NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系、转移电子数的计算方法.

练习册系列答案
相关题目
下列关于有机化合物的叙述正确的是( )
| A、用NaOH溶液可以除去乙酸乙酯中的乙酸 |
| B、乙烯和苯都能与溴水反应而使溴水褪色 |
| C、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
| D、脂肪、糖类和蛋白质都是人体重要的营养物质 |
短周期主族元素A、B、C、D的原子序数依次增大.它们的原子序数之和为25,原子最外层电子数之和为
11. A与D同主族,且在周期表的S区.B与C是同周期相邻元素.则下列叙述正确的是( )
11. A与D同主族,且在周期表的S区.B与C是同周期相邻元素.则下列叙述正确的是( )
| A、四种元素的原子半径:A<B<C<D |
| B、四种元素A、B、C、D的氧化物都不止一种 |
| C、由B与A组成的化合物的沸点一定低于由C与A组成的化合物的沸点 |
| D、CaA2、CaB2这两种化合物中,阳离子与阴离子个数比均为1:2 |
X、Y、Z三种短周期元素在周期表中的位置如图所示,已知X、Z可分别与Y形成化合物A和B,X与Y的质子数之和等于Z的质子数,则下列说法正确的组合是( )
①Y、Z形成的单质均存在同素异形体
②A的种类比B多
③常温下,Y的氢化物中无H+
④Z的最高价氧化物对应的水化物能与X的常见氢化物形成三种盐.
| X | Y |
| Z |
②A的种类比B多
③常温下,Y的氢化物中无H+
④Z的最高价氧化物对应的水化物能与X的常见氢化物形成三种盐.
| A、①②③④ | B、①②④ |
| C、②④ | D、①② |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、1mol NaHSO4晶体含有2NA个离子 |
| B、1L2mol/L明矾溶液经水解可得到氢氧化铝胶体粒子的数目为2NA个 |
| C、1mol CH3+(碳正离子)中含有的电子数为10NA |
| D、在O2参与的反应中,1molO2作氧化剂时得到的电子数一定是4NA |
传统合成氨工业需要采用高温、高压和催化剂.近来美国化学家使用新型铁系催化剂,在常温下合成了氨气.下列说法正确的是( )
| A、新型合成氨方法是吸热反应 |
| B、新型合成氨方法可简化生产设备 |
| C、新型催化剂提高了N2和H2的转化率 |
| D、两种方法中该反应的化学平衡常数相同 |
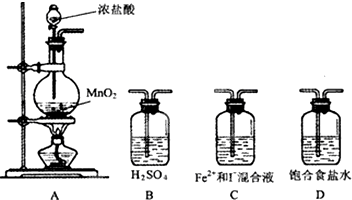 某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.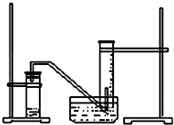 某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?