题目内容
6.下图是由常见元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(部分物质已经略去).其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
(1)写出C→E的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,干燥C常用碱石灰(填写试剂名称).
(3)E物质遇到D物质时,会观察到无色气体变为红棕色现象,若用排水法收集F,则最终集气瓶中收集到的气体为NO(填写物质的化学式).
(4)写出A→D的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(5)标准状况下,把4.48L A通过一定量的过氧化钠固体后收集到3.36L气体,则这3.36L气体的质量是6.0g.
分析 无色无味气体A与过氧化钠反应的得到气体D,则A为CO2,D为O2,C是使湿润的红色石蕊试纸变蓝的气体,应为NH3,氢气与B反应生成C,则B为N2,氨催化氧化生成E为NO,NO与氧气反应生成F为NO2,G与Cu反应可以得到NO或二氧化氮,则G为HNO3,M是最常见的无色液体,与二氧化氮反应得到硝酸,则M为H2O,据此解答,
(1)C→E的反应为氨的催化氧化生成一氧化氮和水;
(2)实验室常用加热氯化铵和氢氧化钙两种固体混合物的方法制备物质氨气,氨气是碱性气体用碱石灰干燥;
(3)E为NO,E物质遇到空气时,会观察到 无色气体变为红棕色现象,F为二氧化氮,和水反应生成硝酸和一氧化氮,排水法收集得到一氧化氮;
(4)A→D的反应为过氧化钠与二氧化碳反应生成氧气;
(5)根据气体的体积差,通过差量法计算参加反应的二氧化碳体积、生成的氧气的体积,判断3.36L气体的组成及各成分的体积,再根据n=$\frac{V}{{V}_{m}}$计算各组分气体的物质的量,利用m=nM计算质量.
解答 解:无色无味气体A与过氧化钠反应的得到气体D,则A为CO2,D为O2,C是使湿润的红色石蕊试纸变蓝的气体,应为NH3,氢气与B反应生成C,则B为N2,氨催化氧化生成E为NO,NO与氧气反应生成F为NO2,G与Cu反应可以得到NO或二氧化氮,则G为HNO3,M是最常见的无色液体,与二氧化氮反应得到硝酸,则M为H2O,
(1)C→E的反应为氨的催化氧化,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)实验室常用加热氯化铵和氢氧化钙两种固体混合物的方法制备物质氨气,其化学方程式为:2 NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,干燥C常用 碱石灰,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;碱石灰;
(3)E为NO,E物质遇到空气时,会观察到无色气体变为红棕色现象,若用排水法收集F,则最终集气瓶中收集到的气体为 NO,
故答案为:无色气体变为红棕色; NO;
(填写物质的化学式).
(4)A→D的反应为过氧化钠与二氧化碳反应生成氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(5)令参加反应的CO2气体的体积为a,生成的O2的体积为b,则:
2CO2+2Na2O2=2Na2CO3+O2 气体体积减小△V
2 1 1
a b 4.48L-3.36L=1.12L
解得:a=2.24L,b=1.12L,
生成氧气的体积1.12L,参加反应二氧化碳2.24L,所以3.36L气体中CO2体积为4.48L-2.24L=2.24L,
所以3.36L气体的质量为 $\frac{2.24L}{22.4L/mol}$×44g/mol+$\frac{1.12L}{22.4L/mol}$×32g/mol=6.0g,
故答案为:6;
点评 本题考查无机物的推断,涉及N、Na元素化合物知识,侧重于元素化合物知识的考查,C和M的性质及A能与过氧化钠反应是推断突破口,题目难度中等.

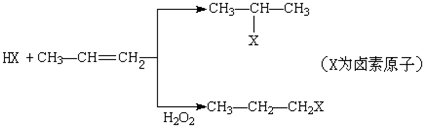
①乙酸 ②乙醇③乙酸乙酯④氯乙烷.
| A. | ① | B. | ②③ | C. | ②④ | D. | ①③④ |
| A. | 醇类-OH | B. | 羧酸-CHO | C. | 酯类-CHO | D. | 醚类 CH3-O-CH3 |
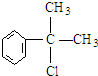
 的物质,该物质是一种香料.
的物质,该物质是一种香料.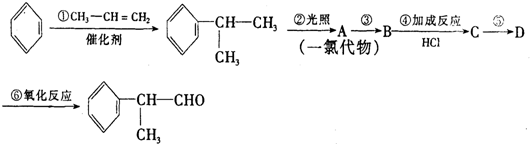
 ,
, .
.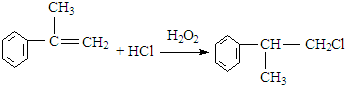 .反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):
.反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):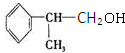 +NaCl.
+NaCl.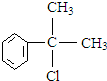 的水解产物
的水解产物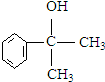 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. ,
, ,
, .
.