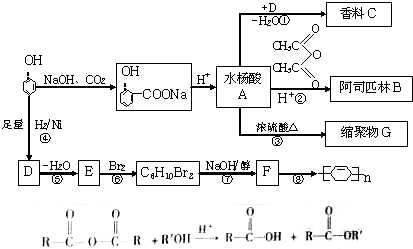
题目内容
某无色溶液,其中可能存在如下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关实验,结果与如图所示.试回答下列问题:
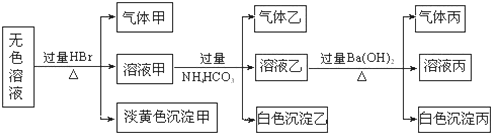
(1)生成沉淀甲的离子方程式为 .
(2)沉淀丙是 .
(3)气体甲的成分有哪几种可能 .
(4)综合上述信息,可以肯定存在的离子有 ,一定不存在的离子是 ,可能存在的离子是 .

(1)生成沉淀甲的离子方程式为
(2)沉淀丙是
(3)气体甲的成分有哪几种可能
(4)综合上述信息,可以肯定存在的离子有
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:无色溶液与过量溴化氢反应生成了气体甲和淡黄色沉淀,沉淀若是溴化银,则不存在S2-、CO32-、SO32-,就不能生成气体,所以淡黄色沉淀为单质硫,是硫化氢与二氧化硫反应生成的,溶液中一定存在硫离子和亚硫酸根离子;
溶液甲中含有过量的溴化氢,与过量的碳酸氢铵反应,生成的气体乙为二氧化碳,白色沉淀只能为氢氧化铝;溶液乙与过量氢氧化钡溶液反应,生成的气体丙为氨气,白色沉淀为碳酸钡或者硫酸钡,
(1)淡黄色沉淀为单质硫,是氢离子与硫离子、亚硫酸根离子反应生成的;
(2)钡离子能够与碳酸根离子、硫酸根离子生成碳酸钡和硫酸钡沉淀;
(3)题中能够与溴化氢生成气体的离子有硫离子、亚硫酸根离子和碳酸根离子;
(4)根据以上推断判断一定存在和一定不存在的离子及可能存在的离子.
溶液甲中含有过量的溴化氢,与过量的碳酸氢铵反应,生成的气体乙为二氧化碳,白色沉淀只能为氢氧化铝;溶液乙与过量氢氧化钡溶液反应,生成的气体丙为氨气,白色沉淀为碳酸钡或者硫酸钡,
(1)淡黄色沉淀为单质硫,是氢离子与硫离子、亚硫酸根离子反应生成的;
(2)钡离子能够与碳酸根离子、硫酸根离子生成碳酸钡和硫酸钡沉淀;
(3)题中能够与溴化氢生成气体的离子有硫离子、亚硫酸根离子和碳酸根离子;
(4)根据以上推断判断一定存在和一定不存在的离子及可能存在的离子.
解答:
解:由于无色溶液与过量溴化氢反应生成了气体甲和淡黄色沉淀,沉淀若是溴化银,则不存在S2-、CO32-、SO32-,就不可能生成气体甲,所以淡黄色沉淀为单质硫,是硫化氢与二氧化硫反应生成的,溶液中一定存在硫离子和亚硫酸根离子,一定不会存在Ag+、Ba2+、Al3+;
溶液甲中含有过量的溴化氢,与过量的碳酸氢铵反应,生成的气体乙为二氧化碳,白色沉淀只能为氢氧化铝,说明原溶液中一定含有偏铝酸根离子;
溶液乙与过量氢氧化钡溶液反应,生成的气体丙为氨气,白色沉淀为碳酸钡或硫酸钡,
所以溶液中一定存在的离子有:Na+、S2-、SO32-、AlO2-; 一定不存在的离子为:Ag+、Ba2+、Al3+;可能存在的离子为:CO32-、SO42-,
(1)生成的淡黄色沉淀为单质硫,反应的离子方程式为:6H++2S2-+SO32-═3S↓+3H2O,
故答案为:6H++2S2-+SO32-═3S↓+3H2O;
(2)白色沉淀丙中一定含有过量的碳酸氢铵与氢氧化钡反应生成的碳酸钡沉淀,可能含有原溶液中的硫酸根离子与钡离子生成的硫酸钡,
故答案为:BaCO3(或BaCO3和BaSO4);
沉淀乙为Al(OH)3,生成沉淀乙的离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al(OH)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)加入溴化氢后,若硫离子过量,生成的气体甲为硫化氢;若亚硫酸根离子过量,生成的气体甲为二氧化硫;若存在碳酸根离子,生成的二氧化硫与硫化氢恰好反应,则生成的气体甲为二氧化碳,二氧化硫过量,气体为二氧化碳和二氧化硫,硫化氢过量,则气体为二氧化碳和硫化氢的混合物;
故答案为:H2S或SO2或CO2或H2S与CO2或SO2与CO2;
(4)根据以上分析,原溶液中一定存在的离子有:Na+、S2-、SO32-、AlO2-; 一定不存在的离子为:Ag+、Ba2+、Al3+,可能存在的离子为:CO32-、SO32-、SO42-,
故答案为:Na+、S2-、SO32-、AlO2-; Ag+、Ba2+、Al3+;CO32-、SO42-.
溶液甲中含有过量的溴化氢,与过量的碳酸氢铵反应,生成的气体乙为二氧化碳,白色沉淀只能为氢氧化铝,说明原溶液中一定含有偏铝酸根离子;
溶液乙与过量氢氧化钡溶液反应,生成的气体丙为氨气,白色沉淀为碳酸钡或硫酸钡,
所以溶液中一定存在的离子有:Na+、S2-、SO32-、AlO2-; 一定不存在的离子为:Ag+、Ba2+、Al3+;可能存在的离子为:CO32-、SO42-,
(1)生成的淡黄色沉淀为单质硫,反应的离子方程式为:6H++2S2-+SO32-═3S↓+3H2O,
故答案为:6H++2S2-+SO32-═3S↓+3H2O;
(2)白色沉淀丙中一定含有过量的碳酸氢铵与氢氧化钡反应生成的碳酸钡沉淀,可能含有原溶液中的硫酸根离子与钡离子生成的硫酸钡,
故答案为:BaCO3(或BaCO3和BaSO4);
沉淀乙为Al(OH)3,生成沉淀乙的离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al(OH)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)加入溴化氢后,若硫离子过量,生成的气体甲为硫化氢;若亚硫酸根离子过量,生成的气体甲为二氧化硫;若存在碳酸根离子,生成的二氧化硫与硫化氢恰好反应,则生成的气体甲为二氧化碳,二氧化硫过量,气体为二氧化碳和二氧化硫,硫化氢过量,则气体为二氧化碳和硫化氢的混合物;
故答案为:H2S或SO2或CO2或H2S与CO2或SO2与CO2;
(4)根据以上分析,原溶液中一定存在的离子有:Na+、S2-、SO32-、AlO2-; 一定不存在的离子为:Ag+、Ba2+、Al3+,可能存在的离子为:CO32-、SO32-、SO42-,
故答案为:Na+、S2-、SO32-、AlO2-; Ag+、Ba2+、Al3+;CO32-、SO42-.
点评:本题考查离子的共存及离子反应,利用流程及离子之间的反应推断出存在离子是解答的关键,注意过量离子及电荷守恒的应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
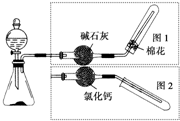 如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )
如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )| 发生装置中的药品 | 干燥和集气装置 | |
| A | 铜和稀硝酸 | 图2 |
| B | 氧化钙和浓氨水 | 图2 |
| C | 锌和稀盐酸 | 图1 |
| D | 大理石和稀盐酸 | 图1 |
| A、A | B、B | C、C | D、D |
污水处理厂检测出一批污水中含有较多的重金属Ag+,欲将其除去,应加入适量的( )
| A、NaCl |
| B、BaSO4 |
| C、Al2O3 |
| D、HNO3 |
我国著名化工专家侯德榜先生提出的“侯氏制碱法”大大推进了纯碱工业的发展,他的贡献之一是( )
| A、找到了新型高效催化剂 |
| B、充分利用了能量 |
| C、提高了纯碱产品的纯度 |
| D、有效减少了环境污染 |
下列说法正确的是( )
| A、在任何条件下,纯水都呈中性 |
| B、pH<7的溶液一定呈酸性 |
| C、25℃时,纯水和稀酸溶液中水的离子积常数不相符 |
| D、pH均等于6的NH4Cl溶液和CH2COOH溶液中,水的电离程度相同 |
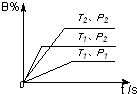 已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )| A、T1<T2,P1>P2,m+n>p,Q>0 |
| B、T1>T2,P1<P2,m+n>p,Q<0 |
| C、T1<T2,P1>P2,m+n<p,Q>0 |
| D、T1>T2,P1<P2,m+n<p,Q>0 |
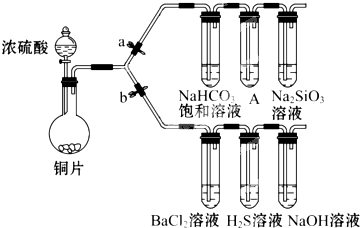 根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)