题目内容
20.已知:CH3Cl常温下为气态,难溶于水,易溶于乙醇等有机溶剂.实验室制备CH3Cl原理为:CH3OH+HCl(浓)$→_{150℃}^{ZnCl_{2}}$CH3Cl↑+H2O
(1)实验步骤如下:
①由ZnCl2•6H2O晶体制得无水ZnCl2的实验方法是在干燥的HCl气流中加热;
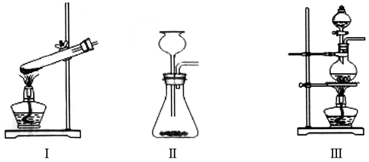
②称取13.6g研细的无水ZnCl2,量取20mL浓盐酸、一定量的CH3OH,分别放入下列最佳装置Ⅲ(填装置编号)的对应仪器中;
③产生的CH3Cl气体,最好选用排水法(填“向上排空气法”、“向下排空气法”或“排水法”)收集,原因是CH3Cl难溶于水,用排水法收集同时可除去HCl、CH3OH等杂质气体.
(2)为探究CH3Cl与CH4分子稳定性的差别,某化学兴趣小组设计实验验证CH3Cl能被强氧化剂酸性高锰酸钾溶液氧化.(已知:CH3Cl被酸性高锰酸钾溶液氧化生成两种气体)
①将CH3Cl制备装置中产生的气体依次通过装有下列试剂的洗气瓶BAC(填编号顺序).
A.1.5%KMnO4(H+)溶液B.蒸馏水C.NaOH溶液
如果观察到KMnO4溶液紫色褪去现象,则证明CH3Cl稳定性弱于CH4,其反应的离子方程式为10CH3Cl+14MnO4-+42H+═14Mn2++10CO2↑+5Cl2↑+36H2O;
②为处理未反应完的CH3Cl,还应在上述洗气瓶后接一只盛乙醇(或其它有机溶剂)(填试剂名称)的洗气瓶.
分析 本题是利用甲醇与浓盐酸反应制备CH3Cl,涉及具体的制备过程是先在干燥的HCl气流中加热ZnCl2晶体得到无水ZnCl2,再将无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶并滴加一定量的甲醇,经加热后会有CH3Cl生成,因CH3Cl中混有挥发出的HCl及甲醇,选择排水法收集生成的气体的同时还可以除杂,另外还探究了的稳定性及含有CH3Cl尾气的处理;
(1)①因ZnCl2晶体直接加热时,因Zn2+水解,如果直接加热最终得到的是Zn(OH)2,因此要用浓盐酸或HCl气体抑制其水解的同时加热;
②该实验为固液加热型,且反应物易挥发,故选Ⅲ;
③因反应混合物中的盐酸和甲醇均易挥发,生成的CH3Cl中会混有挥发出的杂质,同时CH3Cl难溶于水,选用排水法收集的同时还会有除杂的作用;
(2)①如果CH3Cl能被酸性高锰酸钾氧化,则酸性高锰酸钾溶液本身会褪色,同时可能会生成CO2和Cl2,因此要注意尾气的处理;
②因CH3Cl易溶于乙醇和丙醇等有机溶剂,因此的尾气可选择有机溶剂吸收.
解答 解:(1)①在加热ZnCl2晶体时可选择通HCl气体抑制其水解;
故答案为:在干燥的HCl气流中加热;
②该实验为固液加热型,且反应物易挥发,故选Ⅲ;
故答案为:Ⅲ;
③因CH3Cl中混有易溶于水的杂质气体,用排水法可以即除杂又可收集,故答案为:CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体;
故答案为:排水法;CH3Cl难溶于水,用排水法收集同时可除去HCl、CH3OH等杂质气体;
(2)①如果CH3Cl能被强氧化剂酸性高锰酸钾氧化,可选择先通过盛有水的洗气瓶除去可能混合有的HCl和甲醇,再通过盛有的酸性高锰酸钾洗气瓶,溶液的紫色会褐去,最后通过盛Na2SO3的洗气瓶吸收生成的氯气防污染,CH3Cl与酸性高锰酸钾的反应为:10CH3Cl+14MnO4-+42H+═14Mn2++10CO2↑+5Cl2↑+36H2O;
故答案为:BAC; KMnO4溶液紫色褪去;10CH3Cl+14MnO4-+42H+═14Mn2++10CO2↑+5Cl2↑+36H2O;
②CH3Cl易溶于乙醇和丙醇等有机溶剂,可选择酒精吸收CH3Cl的尾气;
故答案为:乙醇(或其它有机溶剂).
点评 本题考查了物质的制备,涉及实验操作、盐类水解、物质的性质检验及反应原理的探究,综合性较强,但基础性知识偏多,难度不大,离子方程式的书写错误率可能偏高点.

| A. | 每种烃的含氧衍生物中至少有3种元素 | |
| B. | 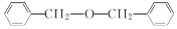 中含有的官能团为醚基 中含有的官能团为醚基 | |
| C. | 所有的有机物中都含有碳,多数含氢,其次还含有氧、氮、卤素、硫、磷等 | |
| D. | 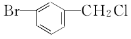 属于芳香卤代烃 属于芳香卤代烃 |
已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
请回答:
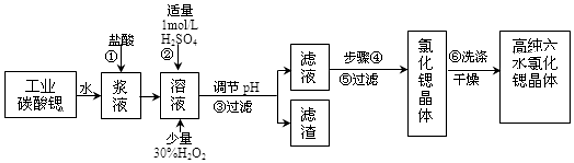
(1)在步骤②中加入少量的30%H2O2,反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为SrO、SrCO3或Sr(OH)2等.过滤所得滤渣的主要成分是Fe(OH)3和BaSO4 .
(3)关于上述流程中的步骤④、⑤、⑥的说法,正确的是A、B.
A.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B.可以通过降低结晶速率的方法来得到较大颗粒的SrCl2•6H2O 晶体
C.某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D.步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和SrCl2溶液
(4)工业上采用减压烘干或者用50~60℃的热风吹干SrCl2•6H2O晶体的原因是防止SrCl2•6H2O 晶体在61℃以上时失去结晶水.
(5)为了测定所得SrCl2•6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.200mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl2•6H2O晶体样品的纯度.用去上述浓度的NH4SCN溶液20.0mL,则原SrCl2•6H2O晶体的纯度为95.3%.
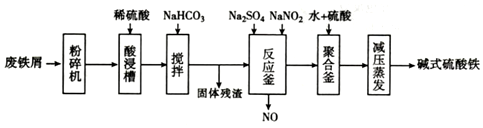
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)粉碎过筛的目的是选取细小颗粒,增大反应接触面积,提高“酸浸”反应速率.
(2)加入少量NaHCO3的目的是调节溶液pH,使溶液中的Al3+完全沉淀.
(3)反应釜中发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为2mol.
(4)聚合釜中溶液的pH必须控制在一定的范围内.pH偏小时Fe3+水解程度弱,PH偏大时则形成Fe(OH)3沉淀.
(5)相对于常压蒸发,减压蒸发的优点是减压蒸发,可防止温度过高,碱式硫酸铁分解.
| A. | 欲检验某溶液中含有Fe2+,先向该溶液中加氯水,再加硫氰化钾 | |
| B. | 常温下,铝罐可以用于盛装浓硝酸,利用了浓硝酸的酸性 | |
| C. | Na2O2与水反应可用于制O2,其中Na2O2既做氧化剂又做还原剂 | |
| D. | 可用HF刻蚀玻璃,是因为玻璃中含有的SiO2具有酸性氧化物的通性 |
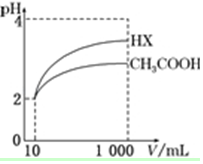 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)同浓度的a.CH3COO-,b.HCO3-,c.CO32-,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(2)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(3)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是b>a>d>c(填编号).
(4)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
①强酸 ②氧化物 ③含氧酸 ④一元酸 ⑤电解质 ⑥混合物 ⑦无机化合物.
| A. | ①③④⑤⑦ | B. | ①②③④⑤⑦ | C. | ①②③④⑥ | D. | ①④⑥⑦ |
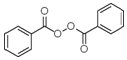 也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程:
也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程: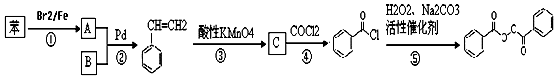
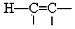 $\stackrel{Pd}{→}$
$\stackrel{Pd}{→}$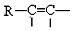
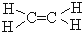 ;
;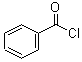 +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$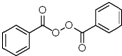 +2HCl;
+2HCl;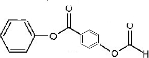 、
、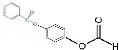 ;
; ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.