题目内容
2.已知化学反应Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K.| 温度 | K |
| 973K | 1.47 |
| 1173K | 2.15 |
(2)该反应平衡常数的表达式为K=$\frac{C(CO)}{C(C{O}_{2})}$.
分析 (1)升高温度平衡向吸热反应进行,结合表中数据判断反应Fe(s)+CO2(g)?FeO(s)+CO(g)的热效应;
(2)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值.
解答 解:(1)由表中数据可知,对于反应Fe(s)+CO2(g)?FeO(s)+CO(g),温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故该反应是吸热反应,
故答案为:吸热;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,当反应中有固体物质参加时,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度,则反应Fe(s)+CO2(g)?FeO(s)+CO(g),化学平衡常数为K=$\frac{C(CO)}{C(C{O}_{2})}$.
故答案为:K=$\frac{C(CO)}{C(C{O}_{2})}$.
点评 本题考查了化学平衡常数的有关知识,根据化学平衡常数与温度的关系确定反应热,注意平衡常数的书写:化学平衡常数表达式中只有气体,为易错点,题目难度不大.

练习册系列答案
相关题目
5.下列做法不正确的是( )
| A. | 使用、制备有毒气体应在通风橱中进行,应有尾气吸收处理装置 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50 mL量筒中配制0.100 0 mol•L-1碳酸钠溶液 | |
| D. | 汞洒落后,应立即撒上硫粉,并打开墙下面的排气扇 |
10.下列图示实验合理的是( )
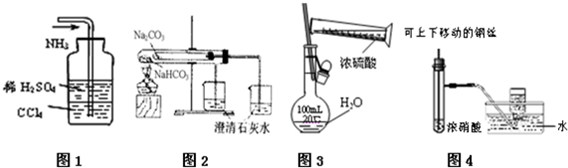

| A. | 图1吸收多余的NH3 | |
| B. | 图2为比较NaHCO3、Na2CO3相对热稳定性 | |
| C. | 图3为配制一定物质的量浓度的硫酸溶液 | |
| D. | 图4为制备并收集少量NO2气体 |
14.可以用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )
| A. | 氯化铁溶液 溴水 | B. | 碳酸钠溶液 溴水 | ||
| C. | 酸性高锰酸钾溶液 溴水 | D. | 酸性高锰酸钾溶液 氯化铁溶液 |
11.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
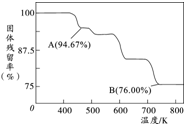 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途. .
.