题目内容
20.用98%浓硫酸配制0.1mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是( )| A. | 未冷却就转移、定容 | B. | 容量瓶内原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 定容时加多了水再用吸管吸出 |
分析 结合c=$\frac{n}{V}$及不当操作导致n偏小或V偏大,则使所配溶液浓度偏低,以此来解答.
解答 解:A.未冷却就转移、定容,V偏小,由c=$\frac{n}{V}$可知,浓度偏高,故A不选;
B.容量瓶内原有少量蒸馏水,对实验无影响,故B不选;
C.定容时俯视刻度线观察液面,V偏小,由c=$\frac{n}{V}$可知,浓度偏高,故C不选;
D.定容时加多了水再用吸管吸出,V偏大,由c=$\frac{n}{V}$可知,则使所配溶液浓度偏低,故D选;
故选D.
点评 本题考查配制一定浓度的溶液,为高频考点,把握物质的量、体积、浓度的关系为解答的关键,侧重分析与实验能力的考查,注意结合公式及操作分析误差,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列各组物质中,所含分子数一定相同的是( )
| A. | lgH2 和 8gO2 | |
| B. | 150℃、1.01×105Pa 时,18LH2O和 18LCO2 | |
| C. | 0.1 molHCl和2.24LHe | |
| D. | 标准状况下,2.24LCCl4和6.02×1022个CO分子 |
8.下列各组中的离子,能在溶液中大量共存的是( )
| A. | Fe3+、Na+、Cl-、OH- | B. | Fe3+、Cl-、K+、Ca2+ | ||
| C. | Cl-、Ca2+、Mg2+、CO32- | D. | Ba2+、K+、CO32-、Cl- |
15.下列做法一定能增加化学反应速率的是( )
| A. | 增大压强 | B. | 使用合适的催化剂 | ||
| C. | 增多反应物的用量 | D. | 增大反应的温度 |
5.下列变化中,属还原反应的是( )
| A. | Cl-→Cl2 | B. | FeCl3→FeCl2 | C. | CO2→NaHCO3 | D. | MnSO4→KMnO4 |
12.常温下测得某无色溶液中由水电离出c (H+)为10-13mol/L,该溶液中一定能大量共存的离子组是( )
| A. | K+、Na+、NO3-、SO42- | B. | K+、Na+、Cl-、Cr2O42- | ||
| C. | Al3+、K+、AlO2-、Cl- | D. | Fe3+、NO3-、SO42-、NH4+ |
9.按要求写出方程式.
(1)碳酸氢铵溶液中加入过NaOH溶液,并加热(写出离子方量程式)NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O.
(2)已知4℃时四种化合物在水中和液氨中的溶解度如表:
上述四种物质在水中形成复分解反应的离子方程式为Ag++Cl-=AgCl↓,在液氨中发生复分解反应的化学方程式为Ba(NO3)+2AgCl=2AgNO3+BaCl2↓.
(1)碳酸氢铵溶液中加入过NaOH溶液,并加热(写出离子方量程式)NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O.
(2)已知4℃时四种化合物在水中和液氨中的溶解度如表:
| AgNO3 | Ba(NO3)2 | AgCl | BaC12 | |
| H2O (液) | 170g | 9.2g | 1.5×10-4g | 33.3g |
| NH3(液) | 86g | 97.2g | 0.8g | 0g |
10.化学与生产、生活、科技等密切相关,下列说法正确的是( )
| A. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 补血口服液中添加维生素c,作为氧化剂 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
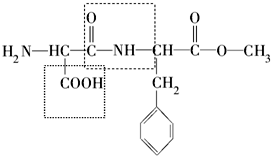 为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:
为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题: