题目内容
12.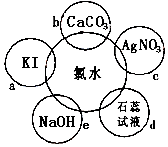 (1)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
(1)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):写出对应的化学方程式
①b2HCl+CaCO3=CaCl2+H2O+CO2↑;
②cHCl+AgNO3=AgCl↓+HNO3;
③eCl2+2NaOH=NaCl+NaClO+H2O;
(2)能证明氯水具有漂白性的现象是石蕊试液最终变为无色;
(3)久置的氯水变为盐酸(填成份),用化学反应方程式表示为2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
(4)实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下:
填写字母2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
①请用双线桥标出该反应的电子转移方向和数目
 .
.②该反应中的氧化剂是高锰酸钾,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol.
分析 氯气溶于水,部分氯气与水反应生成盐酸和次氯酸,氯水中含有氯气、次氯酸分子,含有氢离子、次氯酸根离子、氯离子、少量氢氧根离子,次氯酸具有漂泊性,能够使有色布条褪色,次氯酸受热分解生成氯化氢和氧气,据此解答.
解答 解:(1)①b发生盐酸与碳酸钙反应,反应的化学方程式为:2HCl+CaCO3=CaCl2+H2O+CO2↑,故答案为:2HCl+CaCO3=CaCl2+H2O+CO2↑;
②c是盐酸与硝酸银溶液反应,反应的化学方程式为:HCl+AgNO3=AgCl↓+HNO3,故答案为:HCl+AgNO3=AgCl↓+HNO3;
③氯气与氢氧化钠发生反应,生成氯化钠和次氯酸钠,反应的离子方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)氯水中含有盐酸和次氯酸,盐酸能够使石蕊变红色,而次氯酸具有漂白性,能够是变红的石蕊褪色;故答案为:石蕊试液最终变为无色;
(3)次氯酸不稳定受热分解生成氯化氢和氧气,化学方程式:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,所以久置的氯水变为盐酸;
故答案为:盐酸;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(4)①根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示: ,故答案为:
,故答案为: ;
;
②高锰酸钾是氧化剂,还原剂是浓盐酸,2mol高锰酸钾氧化剂消耗的16mol浓盐酸中,只有10mol浓盐酸做还原剂,所以氧化剂和被氧化的还原剂的量之间的关系为:2KMn04~10HCl,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量1mol,故答案为:高锰酸钾;1mol.
点评 本题考查氧化还原反应的特征和实质以及根据化学方程式的计算知识,是对教材知识的考查,难度不大.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ | |
| C. | 由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定 | |
| D. | 在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
①不溶于水的盐(CaCO3、BaSO4等)都是电解质
②酸、碱、盐都是强电解质
③0.5mol•L-1 所有一元酸中氢离子浓度都是0.5mol•L-1
④电解质在通电情况下才能发生电离
⑤电解质溶液导电的原因是在溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑤⑥ |
| A. | 可以用四氯化碳把溴水中的溴萃取出来,振荡静置分层后,下层液体为无色 | |
| B. | 萃取分液时,从分液漏斗下口流完下层液体,及时关闭.再打开流出上层液体 | |
| C. | 碘易溶于酒精,微溶于水,故可以用酒精萃取碘水中的碘 | |
| D. | 萃取之后,一般通过分液漏斗将互不相溶的液体分离 |
| A. | 无色溶液中:K+、Na+、Cu2+、SO42- | |
| B. | Kw/c(OH-)=10-12 mol•L-1的溶液:Na+、K+、SiO32-、Cl- | |
| C. | 0.1 mol•L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- | |
| D. | 使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
| A. | Na+、Mg2+、Cl-、SO42- | B. | Mg2+、Ca2+、HCO3-、Cl- | ||
| C. | Ba2+、Al3+、Cl-、NO3- | D. | K+、Cu2+、Cl-、SO42- |
 2,2二甲基丁烷.
2,2二甲基丁烷.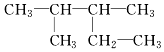 2,3二甲基戊烷.
2,3二甲基戊烷.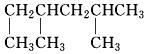 2,4二甲基己烷.
2,4二甲基己烷. mol的硫
mol的硫