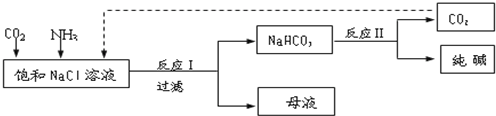
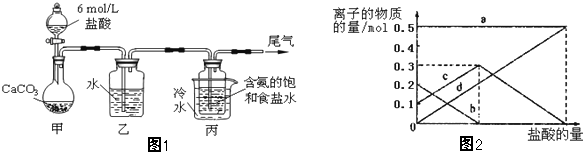
题目内容
下列各组离子在指定溶液中能大量共存的是( )
| A、加入FeCl3溶液:I-、NH4+、Cl-、Ba2+ |
| B、酸性溶液中:Fe2+、Al3+、NO3-、Cl- |
| C、无色溶液中:K+、Na+、MnO4-、SO42- |
| D、硫酸钠的溶液中:Mg2+、K+、HCO3- |
考点:离子共存问题
专题:离子反应专题
分析:A.铁离子具有氧化性,在溶液中能够氧化碘离子;
B.硝酸根离子在酸性条件下能够氧化亚铁离子;
C.高锰酸根离子为有色离子,不满足溶液无色的条件;
D.Mg2+、K+、HCO3-之间不发生反应,都不与硫酸钠反应.
B.硝酸根离子在酸性条件下能够氧化亚铁离子;
C.高锰酸根离子为有色离子,不满足溶液无色的条件;
D.Mg2+、K+、HCO3-之间不发生反应,都不与硫酸钠反应.
解答:
解:A.I-与Fe3+离子发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.MnO4-为有色离子,不满足溶液无色的要求,故C错误;
D.Mg2+、K+、HCO3-之间不反应,且都不与硫酸钠反应,在溶液中能够大量共存,故D正确;
故选D.
B.Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.MnO4-为有色离子,不满足溶液无色的要求,故C错误;
D.Mg2+、K+、HCO3-之间不反应,且都不与硫酸钠反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl- | ||
| B、水电离出的c(H+)=1×10-13的溶液:K+、Mg2+、NO3-、Cl- | ||
C、在
| ||
| D、甲基橙显红色的溶液:Na+、CO32-、NO3-、SO32- |
下列叙述正确的是( )
| A、向次氯酸钠溶液中通入足量SO2气体的离子方程式:ClO-+SO2+H2O→HClO+HSO3- |
| B、向明矾溶液中加入过量NaOH 溶液会产生大量白色沉淀 |
| C、铁粉与足量稀硝酸反应时,氧化剂与还原剂的物质的量之比为2:3 |
| D、浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳 |
如图是周期表中短周期的一部分,A、C的原子序数之和等于B原子的原子序数.下列叙述正确的是( )
| A | C | |
| B |
| A、B的氧化物对应的水化物一定为强酸,且只有氧化性 |
| B、三种元素对应的氢化物中C的氢化物稳定性最好 |
| C、原子半径大小关系为:C>A |
| D、C的单质常温下为无色无味的气体 |
下列物质中既有离子键,又有共价键的是( )
| A、KOH |
| B、CaCl2 |
| C、H2O |
| D、Cl2 |
下列物质中,一定属于同系物的是( )
| A、C2H4 C2H6 |
| B、C2H6 C3H8 |
| C、CH4、C2H4 |
| D、C2H4、C3H4 |