题目内容
19.0.1mol•L-1的下列溶液:①HCl ②H2SO4③CH3COOH ④NaOH,水的电离程度由大到小的顺序正确的是( )| A. | ③>①>②>④ | B. | ④>③>①>② | C. | ③>①=④>② | D. | ①=③=④>② |
分析 酸溶液、碱溶液都抑制了水的电离,酸溶液中的氢离子、碱溶液中的氢氧根离子浓度越大,水的电离程度越小,据此进行解答.
解答 解:①HCl:0.1mol/L的盐酸中氢离子浓度为0.1mo/L;
②H2SO4:0.1mol/L的硫酸中氢离子浓度为0.2mol/L;
③CH3COOH:0.1mol/L的醋酸溶液中氢离子浓度小于0.1mol/L;
④NaOH:0.1mol/L的氢氧化钠溶液中的氢氧根离子浓度为0.1mol/L;
酸溶液和碱溶液都抑制了水的电离,抑制程度取决于酸溶液中的氢离子、碱溶液中的氢氧根离子浓度大小,
所以四种溶液中水的电离程度由大到小的顺序为:③>①=④>②,
故选C.
点评 本题考查了弱电解质的电离及其影响,题目难度不大,明确水的电离及其影响为解答关键,注意酸溶液和碱溶液都抑制了水的电离,能够水解的盐溶液促进了水的电离,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
9.下列基态原子或离子的电子排布式书写不正确的是( )
| A. | Fe3+离子:1s22s22p63s23p63d5 | |
| B. | Cu原子:1s22s22p63s23p63d94s2 | |
| C. | Ni2+离子:1s22s22p63s23p63d8 | |
| D. | Ga原子:1s22s22p63s23p63d104s24p1 |
10.把180mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了加快反应速率而不影响生成H2的总量,下列措施可行的是( )
| A. | 改用20mL 18mol/L的H2SO4实验 | B. | 反应物中加入少量的硝酸钠固体 | ||
| C. | 反应物中加入少量的硫酸铜固体 | D. | 反应物中加入少量的碳酸钠固体 |
7.下列各组排列顺序不正确的是( )
| A. | 热稳定性:碘化氢>溴化氢>氯化氢 | B. | 氧化性:K+<Na+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 原子半径:钠>硫>氯 |
14.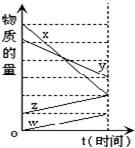 如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
 如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )| A. | 4x+2y=z+w | B. | 6x+5y=4z+w | C. | 3w+z=4x+2y | D. | 2x+y=2z+2w |
8.下列过程中,把化学能转化为热能的是( )
| A. | 风力发电 | B. | 干电池产生电流 | C. | 木炭燃烧 | D. | 用电取暖器取暖 |
 (取代反应)
(取代反应)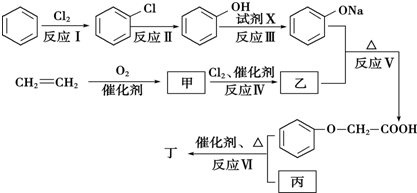
 .
.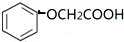 )有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有
)有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有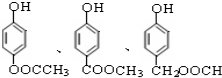 (其中两种)(任写两种即可).
(其中两种)(任写两种即可).