题目内容
6. 如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )
如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )| A. | 左边的电极为电池的负极,a处通入的是甲醇 | |
| B. | 每消耗3.2 g氧气转移的电子为0.4 mol | |
| C. | 电池负极的反应式为:CH3OH+H2O-6e-═CO2+6H+ | |
| D. | 电池的正极反应式为:O2+2H2O+4e-═4OH- |
分析 由电子的方向可知a为负极,b为正极,甲醇在负极被氧化,由题意可知生成CO2和H+,负极反应为CH3OH+H2O-6e-=CO2+6H+,氧气在正极得电子被还原,生成水,正极反应式为O2+4e-+4H+=2H2O,以此解答该题.
解答 解:A、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;所以a处是失电子的一端,通的是甲醇,故A正确;
B、正极是氧气得到电子发生还原反应,反应式为O2+4e-+4H+=2H2O,则每消耗3.2 g氧气转移的电子为0.4 mol,故B正确;
C、负极是甲醇失电子发生氧化反应,依据电池反应和酸性环境,2CH3OH+3O2=2CO2+4H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,故C正确;
D、正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式;电池的正极反应式为:O2+4H++4e-=2H2O,故D错误;
故选D.
点评 本题考查了原电池的原理应用,电极判断,电极名称,电极反应,电极反应式书写的分析判断,掌握原电池原理是解题关键,燃料电池的特征是燃料是电子在负极反应,氧气在正极发生还原反应,题目难度中等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
2.下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
| A. | 均为100mL0.1mol/L的两种溶液可中和等物质的量的氢氧化钠 | |
| B. | pH=3的两种溶液稀释100倍,pH都为5 | |
| C. | 相同浓度的两种溶液中c(H+)相同 | |
| D. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 |
3.下列说法正确的是( )
| A. | N、O、F最高正价依次升高 | |
| B. | 锂、钠、钾、铷单质与水反应置换出氢气越来越难 | |
| C. | F2、Cl2、Br2、I2单质的熔点逐渐降低 | |
| D. | Al3+、Na+、O2-微粒半径依次增大 |
14.下列各组混合物中,不能用分液漏斗进行分离的是( )
| A. | 水和溴苯 | B. | 乙酸乙酯和饱和碳酸钠溶液 | ||
| C. | 碘和四氯化碳 | D. | 硝基苯和水 |
1.下列说法不正确的是( )
| A. | 油脂都不能使溴水褪色 | |
| B. | 多糖都属于天然高分子化合物 | |
| C. | 麦芽糖在一定条件下既能发生水解反应,又能发生银镜反应 | |
| D. | 肽键是蛋白质一级结构中的主键 |
11.下列关于化学反应速率的说法正确的是( )
| A. | 对任何化学反应来说,反应速率越大,反应现象就越明显 | |
| B. | 化学反应速率为“0.8mol•L-1•s-1”所表示的意义是:时间为1s时,某物质的浓度为0.8mol•L-1 | |
| C. | 可逆反应达到化学平衡状态时,当正反应速率增大时,逆反应速率会减小 | |
| D. | 对于放热反应,提高反应温度也能增大反应速率 |
18.下列关于氢氧燃料电池(如图所示)的说法不正确的是( )
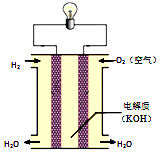

| A. | 通入燃料的一极为负极 | |
| B. | K+、H+向电池的正极移动 | |
| C. | 正、负极材料活泼性不同导致电子发生定向移动 | |
| D. | 借助特殊装置和介质,H2与O2不接触也可发生反应 |
15.生活中的一些问题常涉及化学知识,下列叙述正确的是( )
| A. | 皂化反应就是乙酸乙酯等酯类物质在碱性条件下的水解 | |
| B. | 纤维素可以在人体内水解为葡萄糖,而作人类的营养物质 | |
| C. | 豆浆煮沸后蛋白质变成氨基酸 | |
| D. | 食用油反复加热会产生稠环芳烃等有害物质 |
4.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的.下列环境问题与所对应的物质不相关的是( )
| A. | 破坏臭氧层--氮氧化物 | |
| B. | 酸雨--二氧化碳 | |
| C. | 水体富营养化--含N,P 元素多的废水 | |
| D. | 光化学烟雾--二氧化氮 |