题目内容
18.下列关于氢氧燃料电池(如图所示)的说法不正确的是( )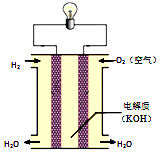
| A. | 通入燃料的一极为负极 | |
| B. | K+、H+向电池的正极移动 | |
| C. | 正、负极材料活泼性不同导致电子发生定向移动 | |
| D. | 借助特殊装置和介质,H2与O2不接触也可发生反应 |
分析 氢氧燃料电池工作时,通入燃料氢气的一极为电源的负极,发生氧化反应,通入氧气的一极为原电池的正极,阳离子移向正极,电子由负极经外电路流向正极,据此分析解答.
解答 解:A、氢氧燃料电池中,H2在负极上被氧化,所以通入燃料的一极为负极,故A正确;
B、原电池工作时,阳离子移向正极,所以K+、H+向电池的正极移动,故B正确;
C、氢氧燃料电池中,H2在负极上被氧化失电子,O2在正极上被还原得电子,所以导致燃料电池电子发生定向移动不是正、负极材料活泼性不同,故C错误;
D、氢氧燃料电池中,H2与O2不接触也可发生反应,故D正确;
故选C.
点评 本题考查氢氧燃料电池的工作原理,题目难度不大,注意正负极的判断及电子流动的原因.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
14.下列关于金属腐蚀与防护的说法不正确的是( )
| A. | 电化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 当钢铁表面水膜呈弱酸性或中性时,主要发生吸氧腐蚀正极反应为:O2-4e-+2H2O=4OH- | |
| C. | 在钢铁设施上连接比铁活泼的金属可防止钢铁腐蚀 | |
| D. | 巨型的铁制桥梁一般采用涂油漆的方法来防生锈 |
9.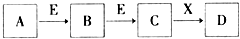 中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
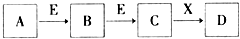 中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 | |
| B. | 若D为NaOH,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| D. | 若D为H2SO4,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
6. 如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )
如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )
 如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )
如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )| A. | 左边的电极为电池的负极,a处通入的是甲醇 | |
| B. | 每消耗3.2 g氧气转移的电子为0.4 mol | |
| C. | 电池负极的反应式为:CH3OH+H2O-6e-═CO2+6H+ | |
| D. | 电池的正极反应式为:O2+2H2O+4e-═4OH- |
13.下列关于有机物说法正确的是( )
| A. | 煤气的主要成分是甲烷 | |
| B. | 若0.2mol某烃在O2中充分燃烧时,生成水和CO2各1.2mol,则该烃为苯 | |
| C. | 乙烯能使溴水和酸性高锰酸钾溶液褪色,其褪色原理不同 | |
| D. | 煤的干馏属于化学变化,而煤的液化和气化属于物理变化 |
3.下列说法正确的是( )
| A. | 常温常压下,1mol蔗糖完全水解生成葡萄糖分子的数目为2NA(NA表示阿伏加德罗常数的值) | |
| B. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | NH4Cl和HCl形成的混合溶液中,可能存在c(Cl-)>c(NH4+)=c(H+)>c(OH-) | |
| D. | SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H<0 |
10.下列说法正确的是( )
| A. | 反应物的总能量大于生成物的总能量的反应一定是吸热反应 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 氨气的还原性可以解释氨气与氯化氢的反应实验 |
7.下列各组离子在指定溶液中能大量共存的是( )
| A. | 强碱性溶液中:K+,Mg2+,SO42- | |
| B. | pH=1的硝酸溶液中:Fe3+,Na+,Cl- | |
| C. | pH=1的盐酸溶液中:AlO2-,Na+,SO42- | |
| D. | 某无色溶液中:Al3+,K+,OH- |